引言:2022年已经开始,那么新年开年第一周有哪些申报的创新药、改良型新药呢?小编对这些情况进行了简单汇总,详情见下(文中统计结果不包括补充申请&进口再注册)。
创新药受理情况
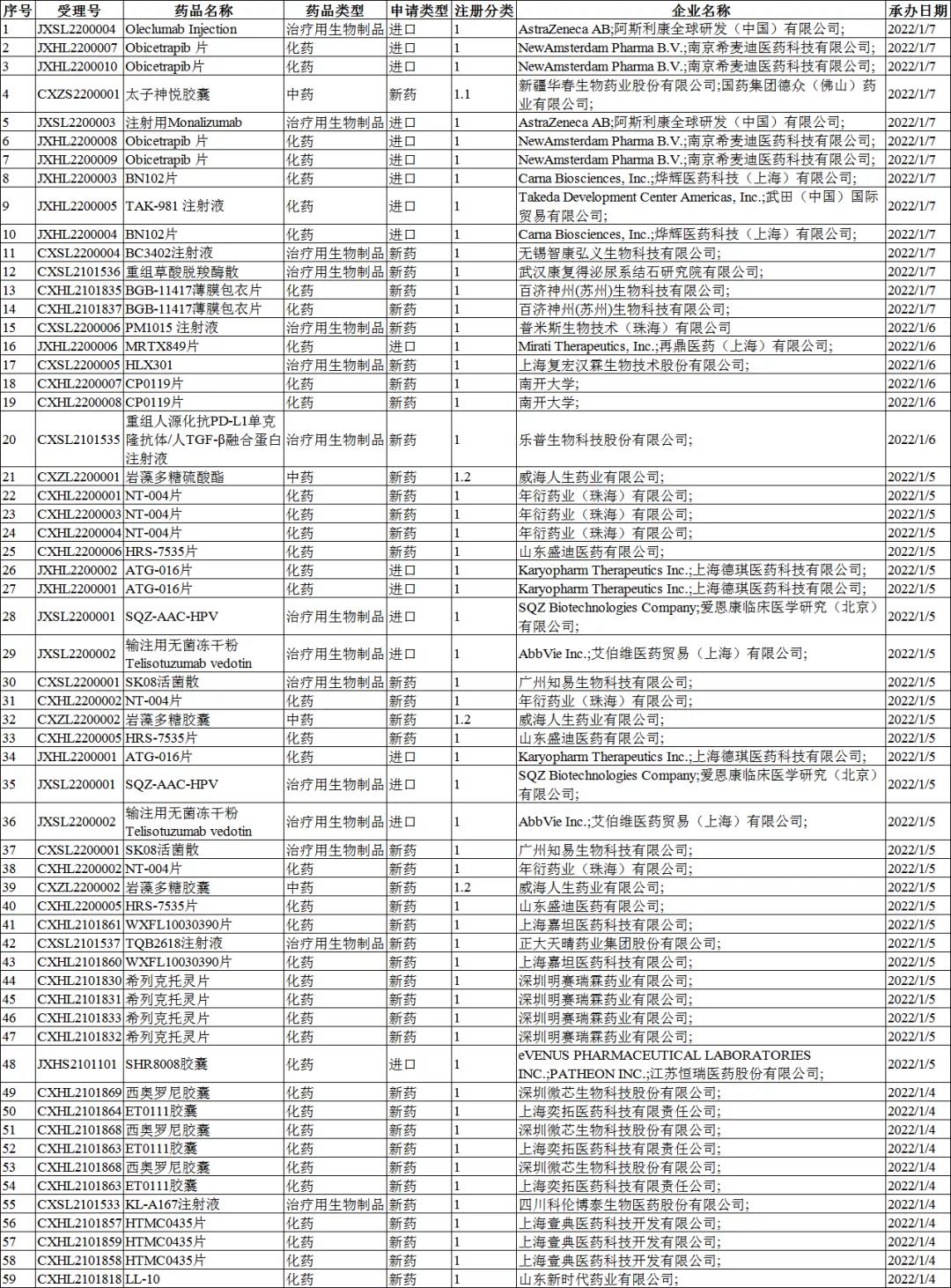
2022年1月4-9日CDE共承办59个创新药受理号,其中包括了化药受理号40个,生物制品受理号15个,4个中药受理号。中药创新药分别为太子神悦胶囊(新疆华春生物&国药集团)、岩藻多糖硫酸酯(威海人生药业)以及岩藻多糖胶囊(威海人生药业)。
在59个受理号中,有57个临床试验申请、有2个上市注册申请。2个上市注册申请分别为太子神悦胶囊(新疆华春生物&国药集团)以及SHR8008胶囊(eVENUS PHARMACEUTICAL LABORATORIES INC.;PATHEON INC.;江苏恒瑞医药股份有限公司;)。
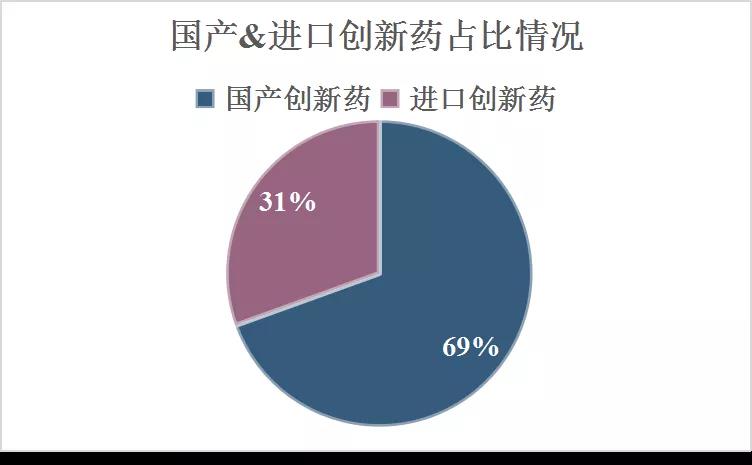
59个受理号中,国产药品受理号41个,进口药品受理号18个。
创新药受理情况
改良型新药受理情况
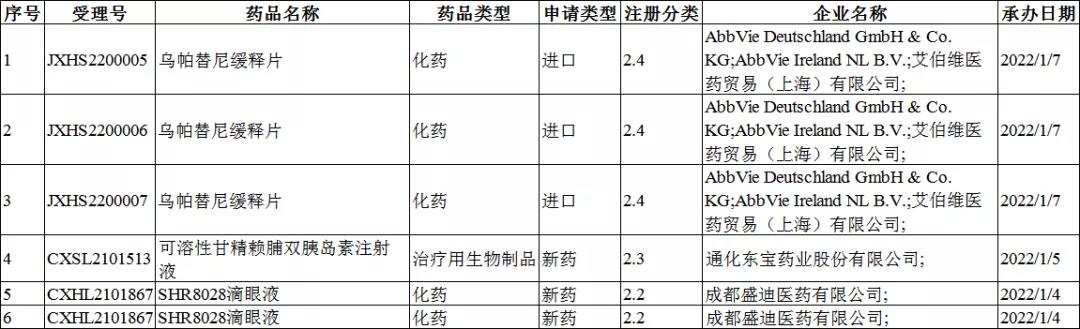
2022年1月4-9日CDE共承办6个改良型新药受理号,其中包括了化药受理号5个,生物制品受理号1个,无中药受理号。化药改良型新药分别为:乌帕替尼缓释片(AbbVie Deutschland GmbH & Co. KG;AbbVie Ireland NL B.V.;艾伯维医药贸易(上海)有限公司;)以及SHR8028滴眼液(成都盛迪医药)。唯一的生物制品类改良型新药为:可溶性甘精赖脯双胰岛素注射液(通化东宝药业)。
其中,化药乌帕替尼缓释片为上市注册申请,其余皆为临床试验申请。
改良型新药受理情况
一致性评价受理情况
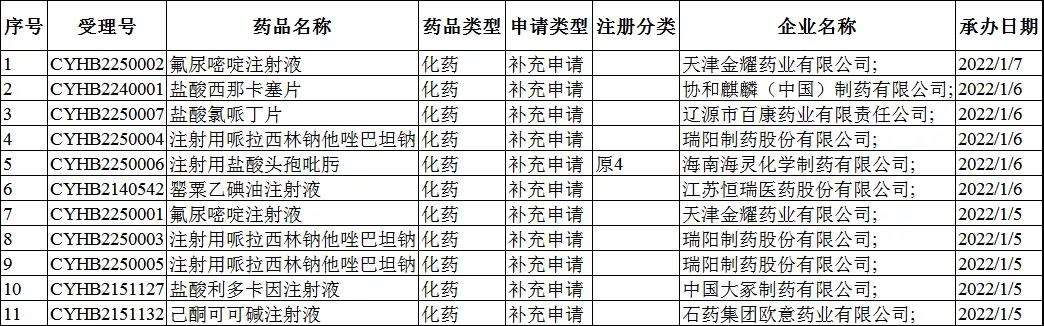
2022年1月4-9日CDE共承办11个一致性评价受理号,详情见下表。
一致性评价受理情况






收藏
登录后参与评论