近年来,药品审评审批改革新政改变了医药研发生态,在“全球新”政策引领下,过去以仿制药申报为主的药品注册申报格局正逐渐被创新药替代。4月份国内有哪些新药获批临床?又有多少款新药获批上市呢?
一、2022年4月国内新药获批临床/生产/进口情况
根据
药融云数据统计,2022年4月共有
82个化药1类新药受理号获CDE承办,其中临床申请63个;共有47个1类治疗用生物制品受理号获得承办,其中临床申请32个。
本月共有124款新药获批临床(共计191个受理号),其中包括49款化药,72款生物制品,3款中药;本月共有6款新药获批上市,其中1款国产,5款进口。
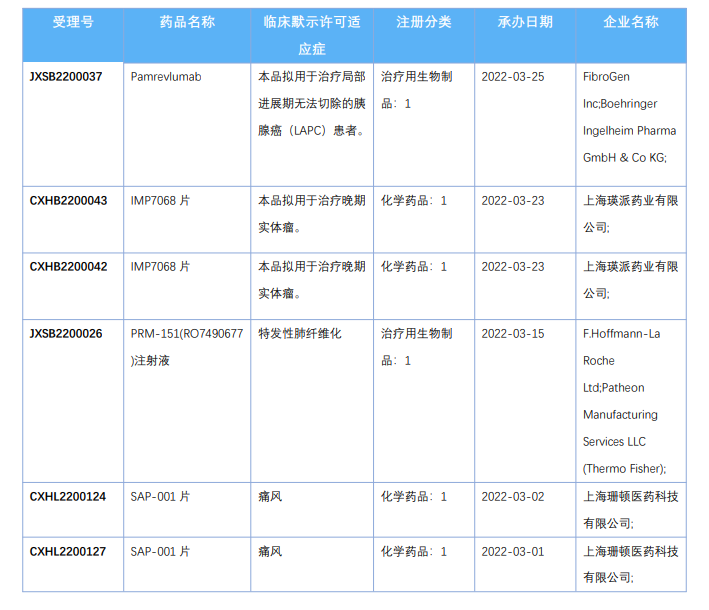
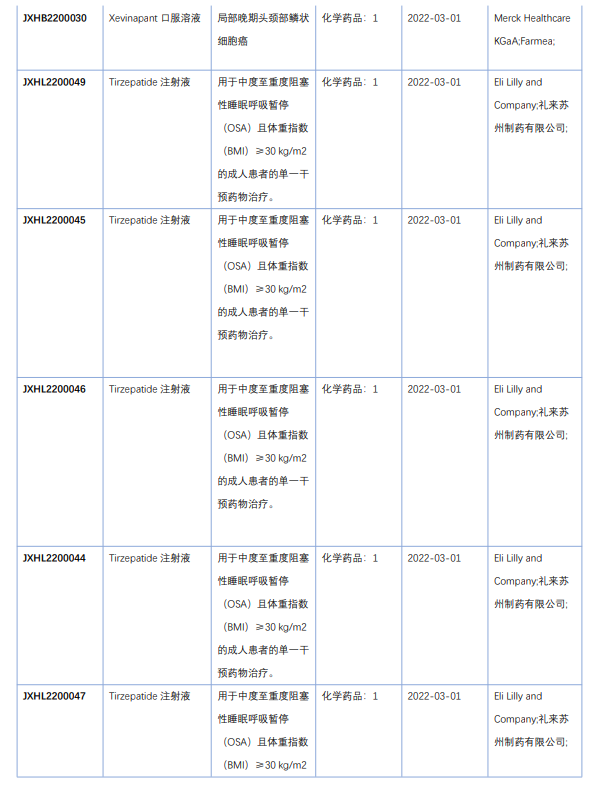
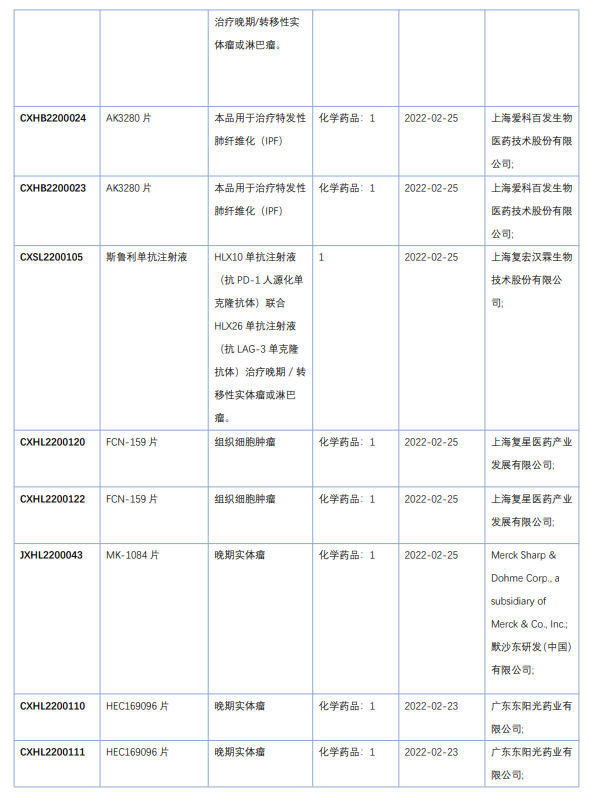
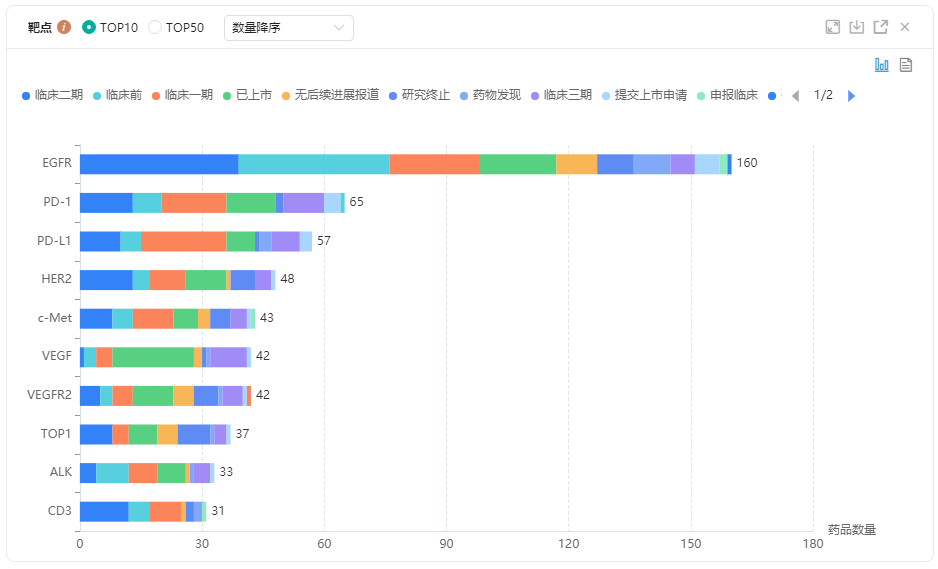
2022年4月国内获批临床新药一览表(部分)
图片来源:药融云《4月全球在研新药与靶点月报》
2022年4月国内获批上市的新药
备注:
(1)此处所列新药,主要是指国家药品监督管理局(NMPA)首次批准在中国上市的药品,包括新分子实体(以及包含有新分子实体的复方)、生物药、中药和疫苗。其中,新分子实体主要是化药注册分类下的1类(境内外均未上市的创新药)、5.1类(境外上市的原研药申请在国内上市);生物药主要是生物制品注册分类下的1类(未在国内外上市销售的生物制品)、2类(单克隆抗体)。获批上市新药不包括生物类似物,新适应症、新剂型。
(2)更多信息如获批临床品种相关靶点、研发企业、全球上市及研发进展及相关靶点全局分析等,可通过药融云全球研发数据库和(或)联系药融云客服获取并下载EXCEL表格。
二、2022年4月获批上市新药解析
4月29日,NMPA官网最新公示,辉瑞洛拉替尼片已在中国获得批准,用于治疗ALK阳性局部晚期或转移性非小细胞肺癌(NSCLC)。
洛拉替尼是一种第三代ALK抑制剂,在携带ALK重排的临床前肺癌模型中显示出高度活性。该药能够抑制对其它ALK抑制剂耐药的ALK基因突变,并可穿过血脑屏障,治疗脑转移瘤。
2017年4月, Lorlatinib被FDA授予突破性药物资格,用于既往接受过一种或多种ALK抑制剂治疗,治疗后疾病进展的、ALK阳性、转移性NSCLC。这一资格的授予是基于一项正在进行的1/2期临床研究的疗效和安全性数据:在41例患者接受Lorlatinib治疗的ALK阳性患者中总应答率为46%,3例患者实现完全应答,16例患者实现部分应答,中位PFS为11.4个月。
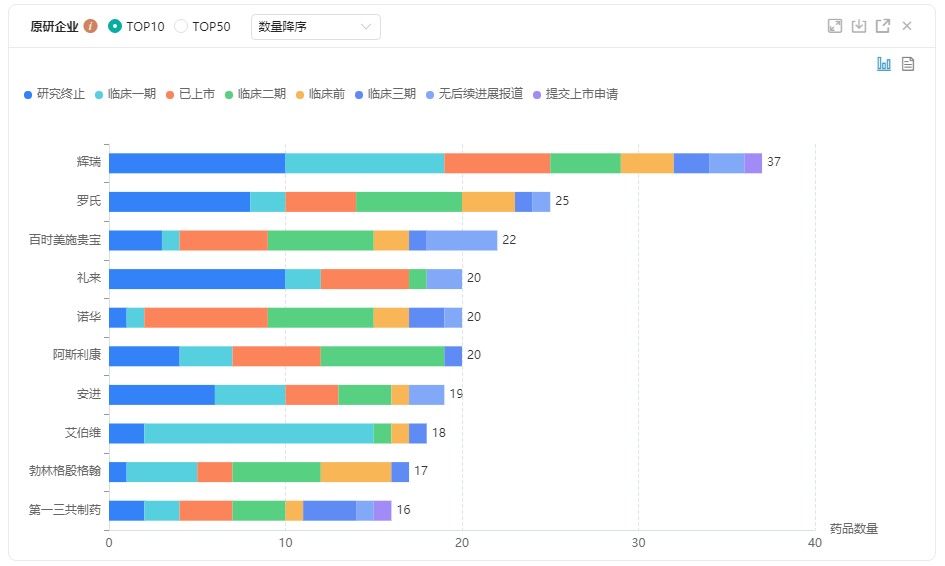
肺癌——原研企业TOP10
肺癌在研靶点TOP10
图片来源:药融云全球药物研发数据库
肺癌是全球癌症导致死亡的首要原因,NSCLC约占肺癌的80-85%。ALK阳性肿瘤约占NSCLC病例的3-5%。大约25-40%的ALK阳性NSCLC患者会在最初诊断后2年内发生脑转移。
除此之外,关于辉瑞公司的以下资讯也值得关注:
(1)辉瑞1类新药注射用PF-06730512在华申报临床 拟用于多种肾病
今日,CDE官网公示,辉瑞在中国申报了1类新药注射用PF-06730512的临床试验申请。公开资料显示,该产品为辉瑞在研潜在“first-in-class”项目,含ROBO2配体陷阱。目前,该产品在全球正处于2期临床研究阶段,拟开发用于治疗一种罕见进行性肾病。
(2)辉瑞JAK1抑制剂阿布昔替尼在中国获批 治疗特应性皮炎
11日,NMPA官网最新公示,辉瑞的口服JAK1抑制剂阿布昔替尼片(abrocitinib,中文商品名为希必可)已在中国获批上市,适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人患者。
(3)辉瑞JAK抑制剂托法替布片新适应症在中国获批
近日,NMPA官网公示,辉瑞申报的枸橼酸托法替布片新适应症上市申请已获得批准。公开资料显示,托法替布为一款JAK抑制剂,已经获美国FDA批准多个适应症。在中国,托法替布于2017年首次获批,目前该药正在针对至少17种疾病开展临床研究。目前尚未从公开信息中查询到此次获批的适应症。
(4)显著改善长期预后!辉瑞公布Lorbrena一线治疗ALK+NSCLC三期试验结果
近日,辉瑞在2022AACR年会上公布了3期CROWN试验的最新结果。该试验在先前没有接受过治疗的间变性淋巴瘤激酶(ALK)阳性晚期非小细胞肺癌(NSCLC)患者中开展,评估了第三代ALK靶向药Lorbrena与第一代ALK靶向药Xalkori(crizotinib,克唑替尼)用于一线治疗的疗效。此次AACR年会上报告的最新分析结果显示,中位随访3年后,Lorbrena与Xalkori相比在主要终点——BICR评估的PFS方面继续表现出显著改善(HR=0.27;95%CI:0.18-0.39),相当于疾病进展或死亡风险降低73%。
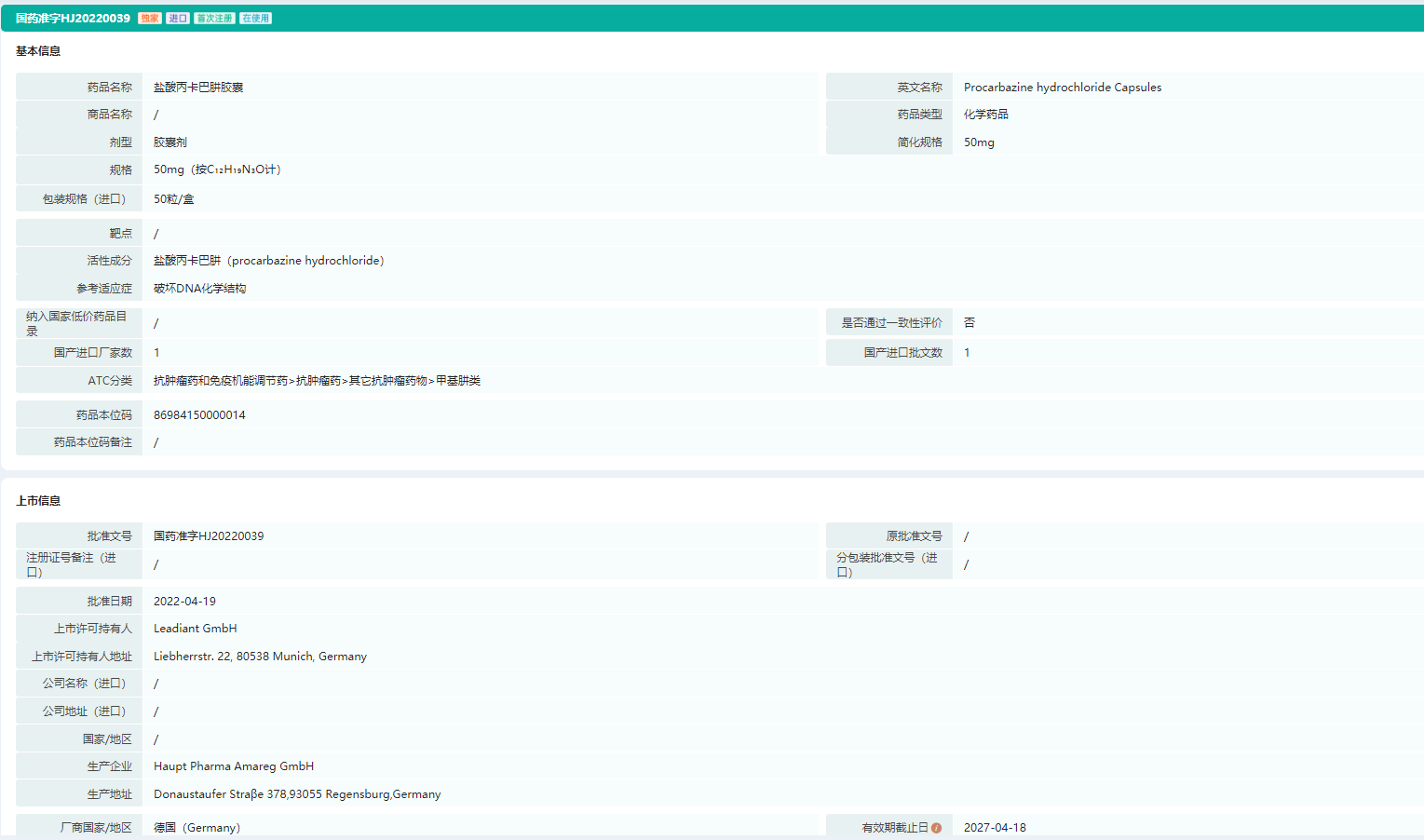
根据中国国家药监局(NMPA)官网公示,李氏大药厂子公司兆科药业申报的抗肿瘤新药盐酸丙卡巴肼胶囊(Natulan)上市申请已于本月获得批准。该产品此次获批的上市申请针对的适应症为:用于治疗晚期霍奇金淋巴瘤。
盐酸丙卡巴肼胶囊属于一种烷化剂药物,也是一种周期非特异性抗肿瘤药,在临床上适用于治疗晚期霍奇金淋巴瘤及部分脑癌(例如多形性胶质母细胞瘤)。据文献报道,该产品的抗肿瘤作用机制为:药物进入体内后经肝微粒体氧化代谢产生甲基或其他烷基自由基,再与DNA作用使其解聚,从而抑制DNA、RNA以及蛋白质的合成。
盐酸丙卡巴肼胶囊—药品批文信息(部分)
图片来源:药融云中国药品批文数据库
公开资料显示,盐酸丙卡巴肼胶囊最初由罗氏(Roche)研发,已在海外获批上市,由Leadiant Biosciences(前身为Sigma-Tau公司)生产。李氏大药厂全资附属公司于2018年5月与Leadiant公司签署经销协议,以推进盐酸丙卡巴肼胶囊在大中华地区独家上市。
- 3. 全新机制(钾离子竞争性酸阻滞剂)抑酸药物:替戈拉生片
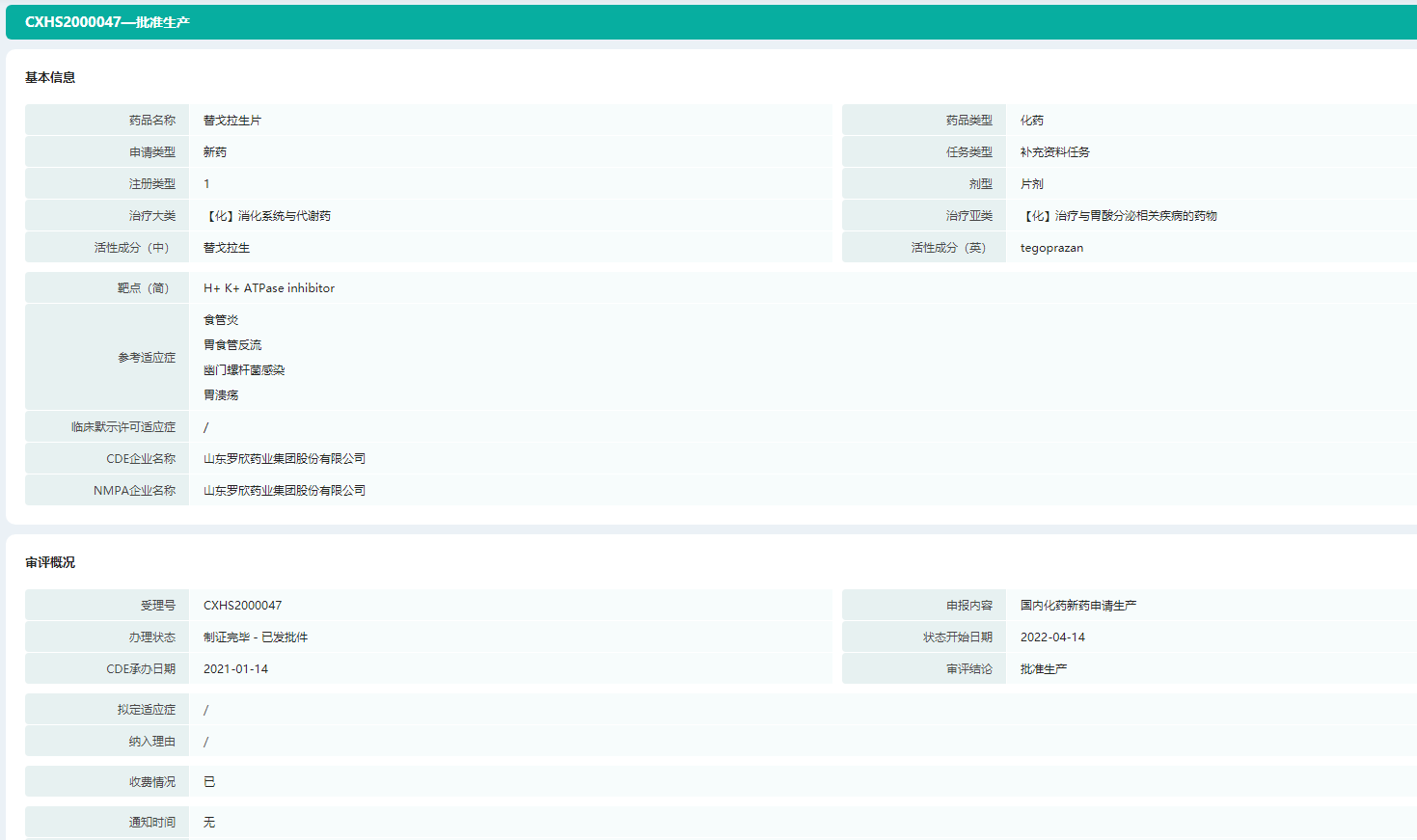
4月14日,罗欣药业集团股份有限公司研发申报的1类创新药替戈拉生片(商品名:泰欣赞®)获得国家药品监督管理局批准用于治疗反流性食管炎(Reflux Esophagitis,简称RE)。
替戈拉生片是中国首款自研的钾离子竞争性酸阻滞剂(P-CAB),通过与钾离子竞争作用,可逆性与H+/K+-ATP酶结合,且能够同时抑制其静息与激活两种状态,从而持久抑制胃酸分泌,为治疗反流性食管炎、改善患者的生活质量带来全新的用药选择。P-CAB替戈拉生片属于国家“重大新药创制”科技重大专项支持研发的高科技成果。
替戈拉生片—药品审评信息(部分)
图片来源:药融云中国药品审评数据库
多年来,传统抑酸类药物如质子泵抑制剂(PPI)常用于反流性食管炎的治疗,而创新药物替戈拉生片作为全新机制抑酸药物,在临床上展现出30分钟快速起效、强效持久抑酸、服用更方便(不受进食时间和代谢基因型影响)等更多优势。
- 4.“不限癌种” 的口服TRK抑制剂:硫酸拉罗替尼胶囊
根据NMPA官网公示,拜耳提交的larotrectinib(硫酸拉罗替尼胶囊)的上市申请已于4月13日获得批准,用于治疗携带NTRK融合基因的实体瘤成人和儿童患者。
公开资料显示,larotrectinib是一款“不限癌种”疗法,它是全球首款专为NTRK基因融合癌症患者设计的口服TRK抑制剂。Larotrectinib最初由拜耳和Loxo Oncology(已被礼来公司「Eli Lilly and Company」收购)联合开发,拜耳公司现拥有该药的全球开发和商业化独家权利。
据悉,它是一款从早期开发时期开始就针对特定基因突变,而不针对特定癌症种类的抗癌新药。在美国,该药曾被FDA授予突破性疗法认定、孤儿药资格和罕见儿科疾病认定。
4月14日,辉瑞希必可®(CIBINQO®, 通用名称:阿布昔替尼片)获得中国国家药品监督管理局批准用于治疗成人中度至重度特应性皮炎(Atopic dermatitis,简称“AD”)。阿布昔替尼片是一款每日一次的口服JAK1抑制剂。
阿布昔替尼片—药品批文信息(部分)
图片来源:药融云中国药品批文数据库
抑制JAK1被认为可以调节参与特应性皮炎病理生理学的多种细胞因子,包括白细胞介素IL-4、IL-13、IL-31、IL-22和胸腺基质淋巴细胞生成素(TSLP)。AD是一种以皮肤炎症和皮肤屏障缺陷为特征的常见慢性皮肤病,过去30年全球范围内AD患病率不断升高。
该病以剧烈瘙痒、反复出现的皮损为特点,还可伴发哮喘、过敏性鼻炎等慢性疾病和失眠症状,极大地降低了患者生活质量。
4月6日,信达生物纤维细胞生长因子受体(FGFR)1/2/3抑制剂佩米替尼片(Pemigatinib)的上市申请获NMPA批准,用于既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者。
据悉,佩米替尼是信达生物于2018年12月从Incyte公司引进的FGFR1/2/3抑制剂,信达生物拥有在中国大陆、香港、澳门和台湾地区的开发和商业化权利。此前佩米替尼已分别在中国台湾和中国香港获批治疗胆管癌患者。胆管癌又称胆道癌,是一种难治而高危的恶性肿瘤,致死率极高,晚期患者的5年生存率仅约5%。
近年来,随着分子靶向药物的迅速发展,胆管癌已有多款靶向药研发成功,终于迎来手术之外的“救命”手段,目前,FDA共批准了3款用于胆管癌的靶向药物,而佩米替尼片为国内首款针对胆管癌的靶向药物。
结语:
新药研发是药企增强实力、抢占市场先机的“金钥匙”。新药研发全球竞赛,是速度和质量的博弈。药企该如何布局,如何发展加速?
所谓知己知彼,才能百战不殆。由药融云咨询团队联合药学数据分析团队联合打造的
药融云《全球在研新药与靶点月报》(简称:药融云月报),每月对全球
新药注册申报和药物研究进展进行分析监测,实时追踪国内医药大健康投融资与发展动向,持续关注国内企业创新药出海/跨国企业在华新药布局动态,全面解读全球热门/潜力靶点、疗法、适应症领域等最新重大事件。
《药融云月报》可以多角度、深层次地帮助在药企从事研发注册、商务拓展(BD)、战略研究,或是在风投、券商从事医药投资、行业分析的用户,快速获取核心医药情报信息,帮助企业洞悉行业发展脉络,扫描中国医药行业的机会与风险,前瞻性地为企业分析、决策提供有力参考。
想要获取《4月全球在研新药与靶点
月报》完整内容,关注公众号“
药融云”(gh_d20f87bd52d9),回复“
4月创新”关键词进行领取。
<END>





















收藏
登录后参与评论