4+7带量采购下,仿制药市场竞争激烈,为获得更大市场,企业应布局高端仿制药或首仿药,具有临床优势的复杂仿制制剂是目前仿制药的开发研究方向。下文我们以复杂制剂
泮托拉唑钠肠溶干混悬剂为例,通过FDA公开的审评报告,对其质量关注点进行分析讨论,以期对企业有所启示。
据
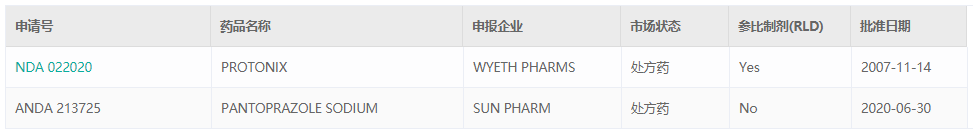
药融云数据库显示,美国有两款泮托拉唑钠的肠溶干混悬剂剂型已通过FDA批准上市。WYETH PHARMS 的 PROTONIX 为新药,于2007年11月14日通过申请;PANTOPRAZOLE SODIUM则为仿制药申请。我国暂时没有泮托拉唑钠肠溶干混悬剂上市产品,也无进口产品获批。
截图来源:药融云FDA批准药品数据库
肠溶干混悬剂与肠溶片等普通剂型相比,便于儿科患者和吞咽困难患者的给药。笔者结合参比制剂泮托拉唑钠肠溶干混悬剂的FDA药学审评报告,从中剖析该品种的质量关注点,以期对企业产生一些启发和帮助,在相似剂型产品开发中可以借鉴和使用文中的相关知识点。下面来重点分析解读一下泮托拉唑钠肠溶干混悬剂参比制剂的FDA审评报告。
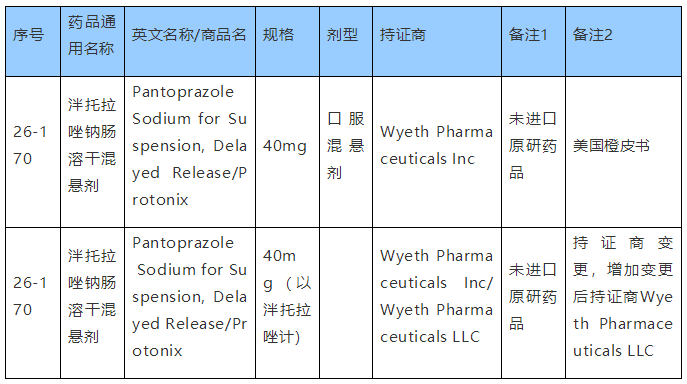
国家局公布了本品的参比制剂,如下表所示:
下面结合FDA披露的部分参比制剂审评报告内容,对本品质量研究的重点关注问题进行探讨。
FDA审评报告中披露的本品质量标准考察项如下图所示:
本品的质量标准考察项目包括形状、含量、鉴别、有关物质、含量均匀度及水分考察项,其中含量、鉴别及有关物质采用液相方法(HPLC法)进行检测,FDA审评报告中对本品质量研究中几个重点关注问题进行了分析讨论,具体如下:
1、有关物质
FDA审评报告显示,本品有关物质限度符合ICH指南要求,且大多数杂质限度与已获批的泮托拉唑钠肠溶片及其注射剂一致;但在泮托拉唑钠肠溶干混悬剂中发现了一个新的降解杂质,该杂质在泮托拉唑钠肠溶片及其注射剂中均未发现,且该杂质结构已通过IR、NMR及MS确证。所以,仿制制剂申报单位应对自制泮托拉唑钠肠溶干混悬剂的降解杂质进行详细研究,根据研究结果制定合理的控制策略,并且要保证自制制剂的质量不低于参比制剂。
2、溶出度
FDA审评报告中关于溶出度检测方面的评价内容截图如下:
FDA审评报告显示,泮托拉唑钠肠溶干混悬剂在酸阶段及缓冲液阶段均采用非专属性的紫外法进行产品溶出水平的检测。原因分析如下:
泮托拉唑钠肠溶干混悬剂在酸阶段不稳定,可能会发生降解,所以酸阶段的溶出量检测方法需要仔细验证和评估,确保当样品完全降解时吸光度能准确地反应出样品的溶出情况,且供试品与对照品的吸光度无显著差异。
在缓冲液阶段,需要解释为什么专属性强的分析方法(如HPLC法)不适用于泮托拉唑钠溶出量的检测。如果专属性强的分析方法不适用,那么企业就需要明确在拟定的紫外分析条件下,处方中各辅料不干扰泮托拉唑钠的检测,确保方法能准确检测出泮托拉唑钠的溶出情况。
如果国内仿制企业的申报标准采用HPLC法对泮托拉唑钠的耐酸力和溶出度进行测定,由于泮托拉唑钠在溶出介质中可能会出现降解情况,进而导致检测结果不准确,即无法确切检测出产品在溶出介质中的溶出情况。在这种情况下企业应分析产品在相关溶出介质中是否存在降解情况,并提供详细的溶出度/耐酸力方法学验证资料,确保拟定分析方法的检测值能真实反应样品的溶出情况。
讨论:随着液相的普及,紫外可见分光光度计(UV)的使用频率在逐渐下降。液相测定方法的专属性较强,能够很好地将辅料或其他干扰组分在色谱柱上分离开,而UV测定法的专属性较差,不能区分原辅料,在某个波长下测得的吸光度值可能是各组分的吸光度之和。UV分析方法的这个缺点在某些情况下可能会成为优点,例如利用UV法测定易降解化合物(如泮托拉唑钠或雷贝拉唑钠)的溶出度,即通过测定原料药和原料药降解产生的化合物的叠加吸光度值来计算药物的溶出度。如选用UV法测定产品的溶出度,需进行较为详实的方法学验证,确保各辅料不干扰样品的测定。
3、水分含量
申报单位在提交的资料中支出,在本品的稳定性预实验中发现产品对水分比较敏感。为更好保证产品质量,仿制制剂应根据实际检测结果及稳定性研究情况,制定合理的水分限度,并与参比制剂进行对比,确保水分含量与参比制剂应无显著差异。
4、给药方式
FDA审评报告中关于给药方式的部分截图如下:
本品是用果汁或果酱制备混悬剂,然后进行口服,或者是将产品用果汁配制成混悬液,然后通过鼻胃管给药。明确指出该肠溶干混悬剂不能用水配制混悬液,而是选用偏酸性的果汁或果酱进行混悬液的配制。原因是不同来源的水会有不同的pH值(其pH范围可能在5.5~8.5之间波动),这就引起一种担忧,即如果用水作为载体配制混悬剂,可能会破坏肠溶衣的完整性,所以本品建议采用偏酸性的果汁或果酱作为载体配制混悬剂,确保肠溶衣的完整性。
5、使用中稳定性
本品使用方法中涉及到鼻胃管给药,企业需参照FDA泮托拉唑钠肠溶干混悬剂的个药指南及FDA的审评报告进行使用中稳定性考察,FDA审评报告中的使用中稳定性截图如下:
仿制制剂本品需提供的使用中研究资料包括以下几点:
①企业需进行体外鼻胃管研究;
②企业需提交产品在果汁和果酱中的化学稳定性,并且有必要确定产品在果汁/果酱中放置2h后的溶出状况;
③企业也有必要提供样品在水中的溶出数据,以更好理解产品说明书中需明确指出泮托拉唑钠肠溶干混悬剂不能在水中配制混悬剂的原因。
讨论:为确保质量和疗效的一致性,仿制制剂的用法用量应与参比制剂保持一致,泮托拉唑钠肠溶干混悬剂的参比制剂说明书中明确本品可以鼻饲给药,所以仿制制剂说明书应与参比制剂保持一致,同时申报企业应提供体外鼻胃管研究资料,其具体研究内容可参考FDA个药指南(兰索拉唑肠溶口崩片及泮托拉唑钠肠溶干混悬剂)及FDA发布的相关指导原则,如《Use of Liquids and/or Soft Foods as Vehicles forDrug Administration: General Considerations for Selection and In Vitro Methodsfor Product Quality Assessments》、《Oral Drug Products Administered Via Enteral FeedingTube: In Vitro Testing and Labeling Recommendations》等。具体需要提交的研究资料主要包括沉降试验、粒度分布试验、回收率试验及耐酸稳定性对比试验等,研究过程中需考虑鼻胃管的材质和型号及介质的pH值等。
以上就是基于FDA审评报告中关于泮托拉唑钠肠溶干混悬剂的重点关注问题进行的分析探讨,希望对大家有用。本文仅代表个人观点,如有不当,还请各位同仁多多批评指正。
大家还想深度了解哪个产品的FDA审评关注点,请在评论区告诉我,我会继续为大家分享(先给自己埋个坑,促使自己不断学习),与大家一起学习,一起进步。
参考文献:
FDA泮托拉唑钠肠溶干混悬剂审评报告
FDA兰索拉唑钠肠溶口崩片个药指南
<END>














收藏
登录后参与评论