引言
从
2011年至2021年的10年时间里,
恒瑞医药一共获得了国家药品监督管理局
10款新药的上市批准。其中8款可查询到首次获批前研发费用投入,分别为:
脯氨酸恒格列净片、羟乙磺酸达尔西利片、海曲泊帕乙醇胺片 、氟唑帕利胶囊、注射用甲苯磺酸瑞马唑仑、注射用卡瑞利珠单抗、马来酸吡咯替尼片、硫培非格司亭注射液(治疗用生物制品9类)。
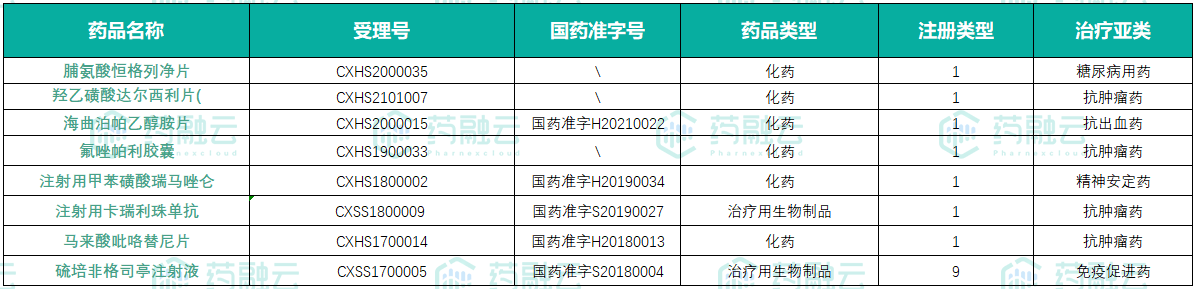
数据来源:药融云中国药品审评数据库
恒瑞医药每款平均研发费用大约在3亿元人民币左右,其中最高的是马来酸吡咯替尼片,前期研发投入约为55,600万元,最低的是注射用甲苯磺酸瑞马唑仑,这款咪达唑仑的改进化合物研发费用投入为7,135万元。但实际上,考虑到周期内未能上市的产品,整体的研发成本肯定会高于目前得到的数值。
不得不说,创新药之间研发费用还是存在极大的差异的。
下文是详细信息:
(恒瑞医药10年上市药物研发费用一览 图源:靶点社整理)
药品名称:脯氨酸恒格列净片
剂型:片剂
注册分类:化学药品 1 类
首次获批适应症:本品适用于改善成人2型糖尿病患者的血糖控制。
2021年12月获批,脯氨酸恒格列净是一种钠-葡萄糖协同转运蛋白 2(SGLT2)抑制剂,通过抑 制 SGLT2,减少肾小管滤过的葡萄糖的重吸收,从而增加尿糖排泄。截至获批时可查询的数据,恒瑞医药脯氨酸恒格列净相关项目累计已投入研发费用约为 27,353 万元。
药品名称:羟乙磺酸达尔西利片
剂型:片剂
注册分类:化学药品 1 类
首次获批适应症:本品联合氟维司群用于激素受体(HR)阳性,人表皮生长因 子受体 2(HER2)阴性的经内分泌治疗后进展的复发或转移性乳腺癌的治疗。
2021年12月获批,羟乙磺酸达尔西利是恒瑞医药自主研发的化学药品 1 类新药,是一种口服、 高效、选择性的小分子 CDK4/6 抑制剂。截至获批时可查询的数据,羟乙磺酸达尔西利相关项目累计已投入研发费用约 36,359 万元。
药物名称:海曲泊帕乙醇胺片
剂型:片剂
注册分类:化学药品 1 类
首次获批适应症:用于因血小板减少和临床条件导致出血风险增加的既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症(ITP)成人患者,以及对免疫抑制治疗疗效不佳的重型再生障碍性贫血(SAA)成人患者。其中SAA适应症为附条件批准。
2021年6月获批,海曲泊帕乙醇胺片是一种口服非肽类血小板生成素受体(TPO-R)激动剂,通过激活 TPO-R 介导的 STAT 和 MAPK 信号转导通路,促进血小板生成。截至获批时可查询的数据,恒瑞医药海曲泊帕乙醇胺片相关项目累计已投入研发费用约为 18,389 万元。
药物名称:氟唑帕利胶囊
剂型:胶囊剂
注册分类:化学药品 1 类
首次获批适应症:用于既往经过二线及以上化疗的伴有胚系 BRCA 突变(gBRCAm)的铂敏感复发性卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。
2020年12月获批,氟唑帕利为小分子PARP抑制剂,可抑制BRCA1/2功能异常细胞中的DNA修复过程,诱导细胞周期阻滞,进而抑制肿瘤细胞增殖。截至获批时可查询的数据,恒瑞医药该产品累计已投入研发费用约为 29,492 万元。
药品名称:注射用甲苯磺酸瑞马唑仑
剂型:注射剂
注册分类:化学药品 1 类
首次获批适应症:用于常规胃镜检查的镇静。
2019年12月获批,注射用甲苯磺酸瑞马唑仑是一种短效的 GABAa 受体激动剂,截至获批时可查询的数据,恒瑞医药该研发项目上已投入研发费用约 7,135 万元人民币。
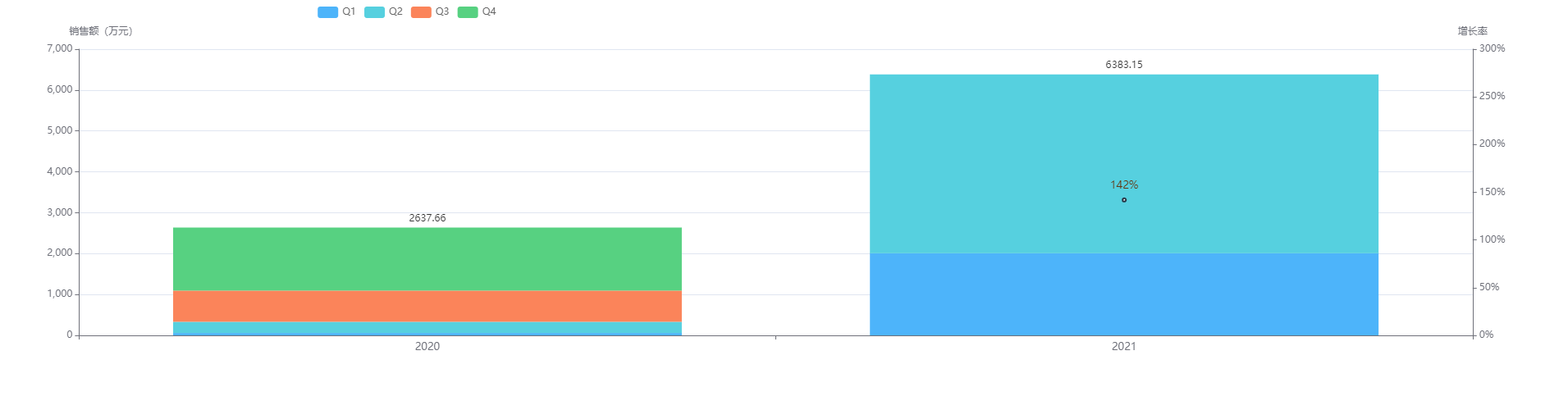
据
药融云数据统计 ,注射用甲苯磺酸瑞马唑仑 2020年的销售额为2637万元,2021年销售额突飞猛进,光H1就已经远超2020全年,达6383万元,今年将会冲破亿元大关。
图片来源:药融云全国医院销售数据库
药品名称:注射用卡瑞利珠单抗
剂型:注射剂
注册分类:治疗用生物制品 1 类
首次获批适应症:有条件批准用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤。
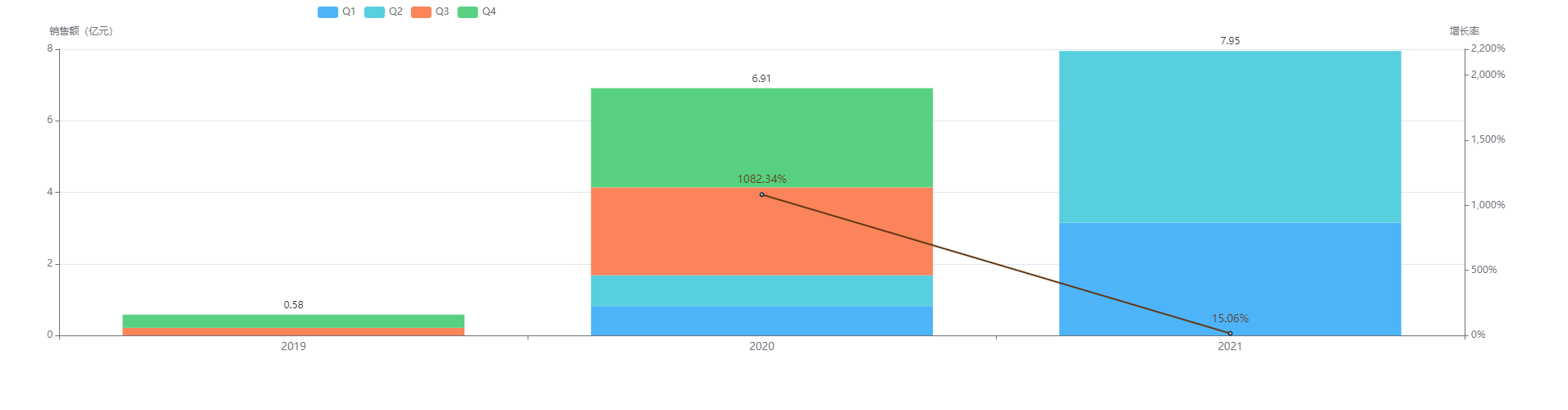
2019年5月获批,注射用卡瑞利珠单抗是人源化抗 PD-1 单克隆抗体,可与人PD-1受体结合并阻断 PD-1/PD-L1 通路,恢复机体的抗肿瘤免疫力,从而形成癌症免疫治疗基础。恒瑞医药该产品项目投入研发费用约为 50,431 万元人民币。
注射用卡瑞利珠单抗在2020年开始走红,销售额达6.91亿元,同比增长1082%。2021年H1已接近8亿元,预计全年有望向20亿元发起冲击。从季度销售额来看,一直处于阶梯增长趋势,并于2021年Q2季度达到顶峰4.8亿元,并预计还会继续增长下去。
图片来源:药融云全国医院销售数据库
药品名称:马来酸吡咯替尼片
剂型:片剂
注册分类:化学药品1类
首次获批适应症:联合卡培他滨,适用于治疗表皮生长因子受体2(HER2)阳性、既往未接受或接受过曲妥珠单抗的复发或转移性乳腺癌患者。使用本品前患者应接受过蒽环类或紫杉类化疗。本次批准为有条件批准。
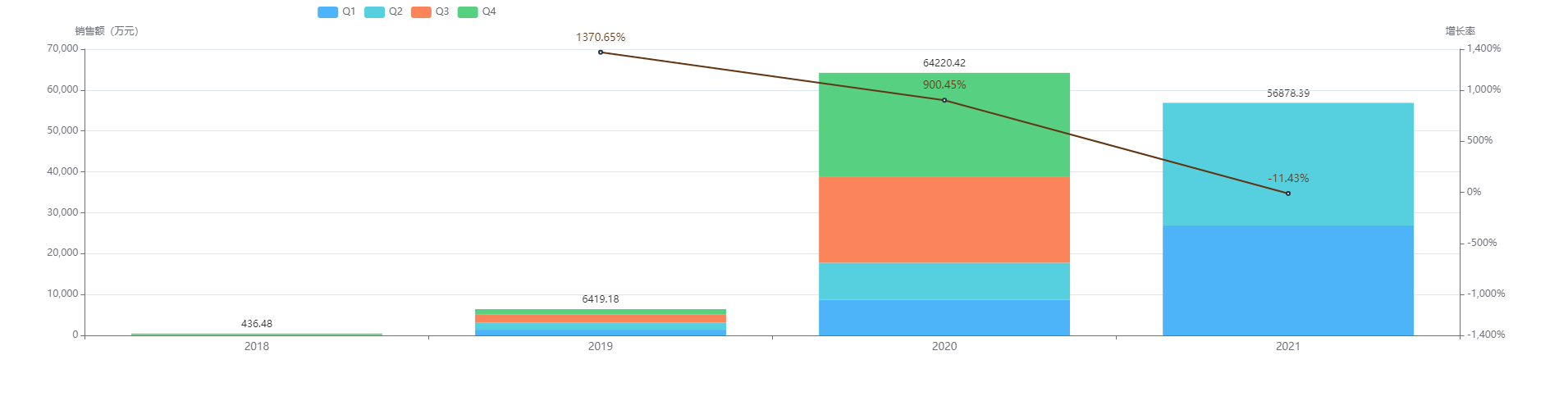
2018年8月获批,马来酸吡咯替尼是不可逆性人表皮生长因子受体2(HER2)、表皮生长因子受体(EGFR)双靶点的酪氨酸激酶抑制剂,其作用机理为与细胞内HER2和EGFR激酶区的三磷酸腺苷(ATP)结合位点共价结合,阻止肿瘤细胞内HER2和EGFR的同质和异质二聚体形成,抑制其自身的磷酸化,阻断下游信号通路的激活,从而抑制肿瘤细胞生长。恒瑞医药该产品的研发项目已投入研发费用约为 55,600 万元人民币。
马来酸吡咯替尼片的销售额2020年同比2019年增长900.45%,达6.42亿元。从季度来看,2020年Q3-2021年Q2销售额呈相对持平且缓慢增长趋势,平均保持在2.6亿元上下,并于2021年Q3达到最高3亿元。预计2021全年销售额也会跨国10亿元的大关。
图片来源:药融云全国医院销售数据库
药品名称:硫培非格司亭注射液
剂型:注射剂
注册分类:治疗用生物制品 9 类
首次获批适应症:适用于非骨髓性癌症患者在接受易引起临床上显著的发热性中性粒细胞减少症发生的骨髓抑制性抗癌药物治疗时,降低以发热性中性粒细胞减少症为表现的感染的发生率。
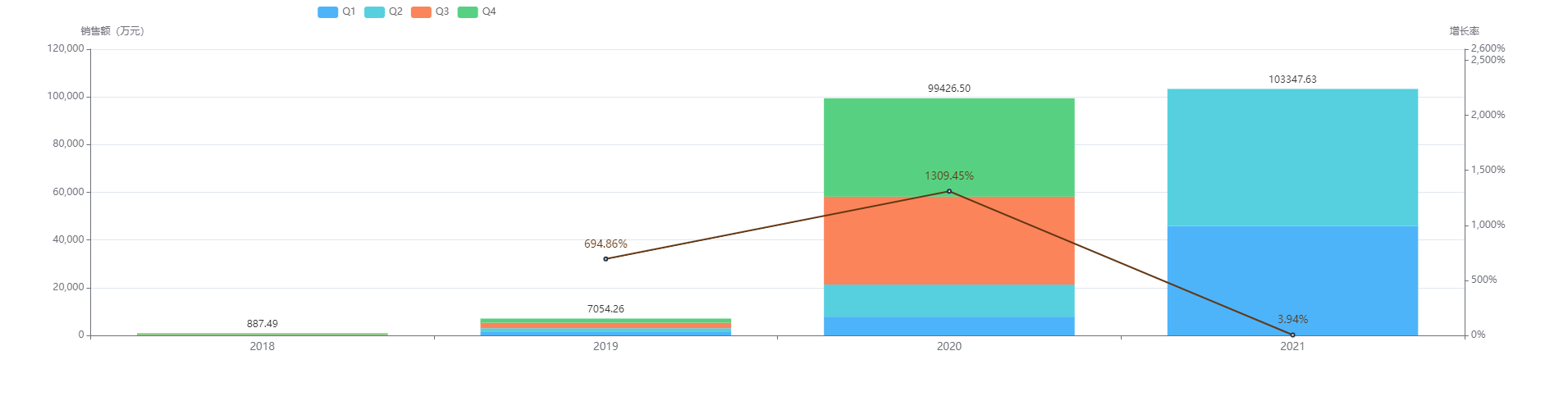
2018年5月获批,硫培非格司亭是恒瑞医药自主研发的生物创新药长效粒细胞集落刺激因子(G-CSF)。截至获批时可查询的数据,硫培非格司亭注射液研发项目上已投入研发费用约为 9800 万元人民币。
硫培非格司亭注射液2019年-2020年的销售额,直接从7千万涨到接近10亿元,同比增长1309.45%。季度销售额也呈阶梯式增长,最大涨幅355.38%,最近几个季度保持在10-30%之间。2021年H1销售额已突破10亿元,全年有望达20亿元。
图片来源:药融云全国医院销售数据库
药品名称:甲磺酸阿帕替尼片
剂型:片剂
注册分类:化学药品1.1类
2014年12月获批,阿帕替尼主要用于晚期胃癌标准化疗失败后的治疗,通过竞争性结合细胞内VEGFR-2的ATP结合位点,抑制酪氨酸激酶的生成从而抑制肿瘤组织新血管的生成。阿帕替尼从立项研发到获批上市前后历时10 年,见证了恒瑞医药自主创新转型的历程。
甲磺酸阿帕替尼片的销售额在2015-2019年一直处于增长趋势,并于2019年达到峰值9.1亿元,2020年出现下跌1.3%。2021年H1销售额已有6.03亿元,全年预计同比会有上升。从季度增长趋势来看,近几个季度也出现相对持平的趋势,平均保持在2.85亿元,但依然在进行非常缓慢的增长。
图片来源:药融云全国医院销售数据库
药品名称:艾瑞昔布片
剂型:片剂
注册分类:化学药品1.1类
2011年6月获批,艾瑞昔布是新一代非甾体抗炎类创新药,主要用于缓解骨关节炎的疼痛症状,这是
恒瑞医药第一个获批上市的国家一类新药。
艾瑞昔布片的销售额在2014年-2019年涨幅较数值大,最大涨幅148.67%。2020年同比2019年增长16.56%,涨幅开始放平。2021年H1销售额已达5.73亿元,预计涨幅大约在65%左右。
图片来源:药融云全国医院销售数据库
参考来源:
[1] NMPA官网
[2] 上市公司公告
[3] 药融云数据库
<END>

 数据来源:药融云中国药品审评数据库
数据来源:药融云中国药品审评数据库



 数据来源:药融云中国药品审评数据库
数据来源:药融云中国药品审评数据库








收藏
登录后参与评论