体外释放试验(in vitro release test,IVRT)是表征和评价半固体制剂性能的有效手段,体外释放速率可以反映药物的溶解度、粒径、剂型流变性等多种理化参数的综合作用,可辨别处方和工艺变化对制剂的影响,是产品开发、质量控制、稳定性考察及产品批准后变更的重要质量控制项目。
IVRT主要用人工膜或合成膜进实验,相较于体外透皮试验( in vitro permeation test,IVPT),具有可操作性强,重现性高,且灵敏度相对较高的特点。后者主要用于人体或动物的离体皮肤进行实验,模拟外用药物在生理条件下的透皮过程,对药物释放性能的试验等效性进行评价,但存在皮肤难以获得、皮肤受种属、年龄、状态、部位等多因素干扰、皮肤处理困难、方法可重现性差等困难因素。
美国食品药品监督管理局(FDA)已发布了多个外用半固体制剂仿制药的指导原则,若干仿制药如处方中的原料药和辅料的质量(Q1)、数量(Q2)及物理性能与微观结构(Q3)和参比制剂相同或相似,完成IVRT后可不必再进行生物等效性研究。各国药品监管部门发布的有关外用半固体制剂研究技术的指导原则中均有关于IVRT的指导意见的描述,但其中一些试验条件与操作方法仍缺乏统一的标准化信息,同时由于语言的差异,导致研究人员在装置设计和实验方案上仍有较大的随意性。研发工作的合理与否,将直接影响结果的可靠性,因此有必要对外用半固体制剂IVRT相关指南及关键技术参数进行对比归纳与总结。
1. 国外指南汇总
FDASUPAC-SS Nonsterile Semisolid Dosage Forms:Scale-Up and Postapproval Changes:Chemistry, Manufacturing, and Controls;In Vitro Release Testing and In Vivo Bioequivalence(1997年)(非无菌半固体制剂:扩大规模和上市后变更:化学、生产和控制的体外释放和体外透皮生物等效原则),第一份关于IVRT的管理文件,以支持SUPAC-SS通过IVRT证明变更前后批次之间的等效性。
PMDA: 局所皮膚適用製剤(半固形製剤及び貼付剤)の処方変更のための生物学的同等性試験ガイドラインについて(局部皮肤应用制剂(半固体制剂和贴剂)制剂变化的生物等效性研究指南),应用IVRT解释释放机制随组成和工艺参数的变化情况。
USP总则<1724> Semisolid Drug Products - Performance Tests (半固体制剂的性能实验)-提供半固体药物产品性能测试方式、原理和应用于该测试的各种设备类型等信息。
FDA Draft Guidance on Acyclovir(2016)(阿昔洛韦指南草案)-为IVRT的方法开发、方法验证、新药/仿制药开发不同阶段优化工艺处方工艺的关键手段提供了指南。
EMA Draft guideline on quality and equivalence of topicalproducts(2018)(
外用制剂质量和等效性指南草案),与FDA相比,提供更严格的参考标准。
USP<725> TOPICAL AND TRANSDERMAL DRUG PRODUCTS—PRODUCT PERFORMANCE TESTS(局部和透皮药物产品-产品性能测定,USP,2009年),提出了设备关键参数种类及可接受范围。
文献,Katrin I, Tiffnera, et .A comprehensive approach to qualify and validate the essential parameters of an in vitro release test (IVRT) method for acyclovir cream, 5%[J]In Pharmaceutics 535(2018)217-227,通过试验进一步对设备关键参数种类及可接受范围进行评估。
2. 国内指南及权威文献汇总
注册分类的皮肤外用仿制药的技术评价要求(征求意见稿,2018),附件中阐述了IVRT及IVPT具体实验方法。
《化学仿制药透皮贴剂药学研究技术指导原则(试行)》(2020年第52号):参考FDA/EMEA/PMDA设计和实施试验。
CFDA文献-郭涤亮等 《皮肤局部外用仿制药质量等同性评价的一般考虑》,参考国内外相关技术指导原则及文献,针对皮肤局部外用仿制药研发和评价面临的复杂性与挑战,从与参比制剂质量等同性考虑,提出皮肤局部外用仿制药应与参比制剂保持最大程度的处方组成(Q1)、用量(Q2)和微观结构特性(Q3)等同的审评考虑。
CFDA文献-张星一等 《皮肤科药物研发中的若干问题解析》,结合实际审评经验,对局部外用皮肤科药物的科学处方开发、原辅料的来源和控制、杂质分析的特点和技术要求、透皮吸收试验的设计与评价、稳定性研究的特点等技术关键点进行汇总和分析。
CFDA文献-田洁 《皮肤外用半固体制剂体外透皮吸收对比试验常见问题分析》,参考国内外相关指导原则及文献, 结合皮肤外用半固体制剂仿制药及相关变更申请的审评情况, 阐述作者对自制样品与原研产品进行体外透皮吸收对比试验技术要求的认识,并分析审评资料常见问题。
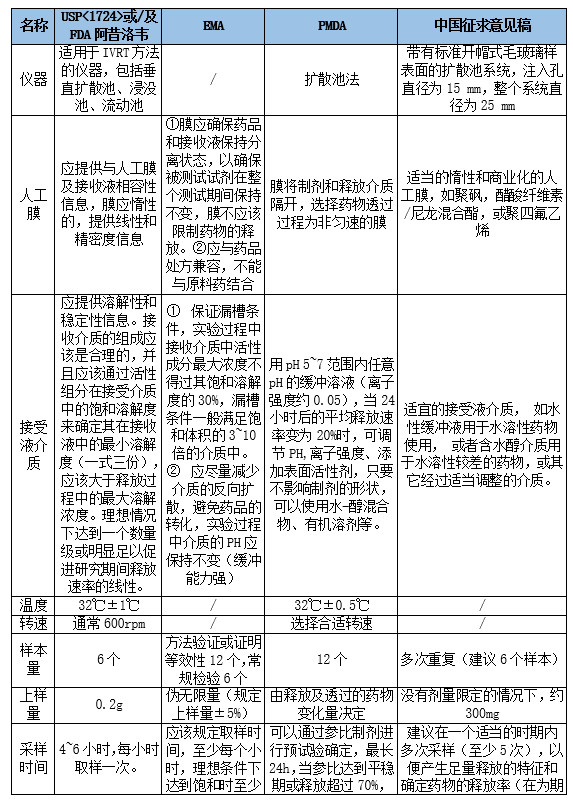
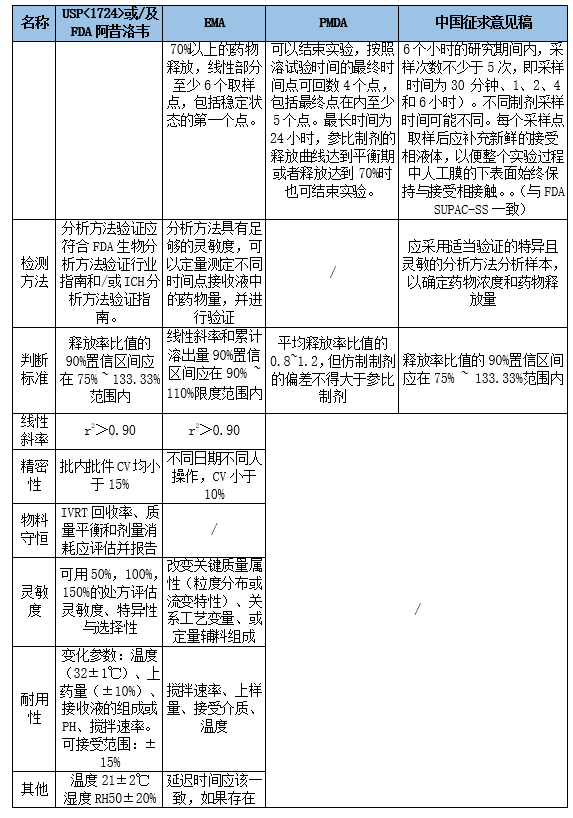
3. 指导原则摘要与关键指标对比
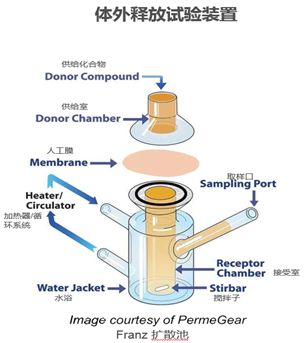
4. 常用检测装置示例(Franz扩散池法)
Franz扩散池装置示意图
原理:制剂处于释放控制过程中时,释放与时间的平方根(t)呈比例,因为释放来自衰减范围内(Higuchi方程)
上样:受试品置于扩散池的开放供体腔人工膜的上侧,采样液置于接受腔人工膜的另一侧。
通过不同时间点取样,并多次重复(一般建议6或12个样本)测定,得到制剂的释放特征数据。
以单位面积累积释放的药物量对时间平方根做图,可得到制剂的释放率,计算自研制剂和参比制剂的中位体释放率比值的90%置信区间。
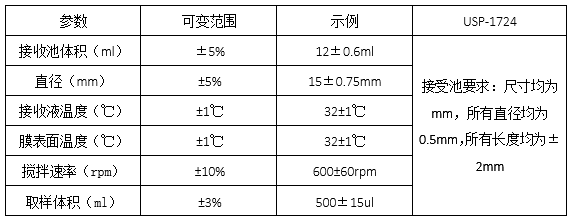
5. 仪器及设备验证规程
设备参数包括:接受室体积、接收池直径(决定接触膜的大小)、接受室液体温度控制、膜的温度。不同仪器的工作原理和具体的测试程序不同,可用制造商提供的有关安装、操作和性能鉴定的相关程序,实验室鉴定扩散池至少包括安装膜孔径的扩散面积、接收池体积、膜表面温度及搅拌速率(FDA阿昔洛韦)。
性能参数:按照USP<1724>章中规定的程序进行,通过使用氢化可的松乳膏进行IVRT实验,通过比较两次IVRT运行在两个不同日期的氢化可的松的释放速率,评估两次IVRT运行的等效性,作为实验室鉴定的一部分,运行内和运行间的变化通过计算每次运行和释放的变化系数来确定。
设备参数可接受范围:
实验室资质可接受范围
6. 结语
本文中的一些实验条件和评判标准为文献值,仅供参考。
下期将结合具体试验对IVRT方法开发、验证、变异来源及控制策略进行讨论。
<END>










收藏
登录后参与评论