炎症性肠病(IBD)是一种慢性进展性肠道疾病,病因和发病机制尚不明确。IBD主要包括克罗恩病和溃疡性结肠炎,由于肠道炎症导致患者出现腹痛、便血、腹泻等症状,给患者的生活质量带来很大影响。
2022年12月7日,
Prometheus Biosciences公司宣布,其潜在“first-in-class”
抗TL1A单克隆抗体PRA023,在治疗溃疡性结肠炎和克罗恩病的两项2期临床试验中获得积极结果,表现出强劲效力和优越的安全性。该公告一出,该
公司当日股价大涨165%。
Prometheus称,基于这些结果该公司计划在今年-2023年启动3期临床试验,评估PRA023治疗溃疡性结肠炎和克罗恩病的效果。
药融云数据库,vip.pharnexcloud.com/?zmt-mhwz显示:Prometheus Biosciences, Inc.(NASDAQ: RXDX)是一家生物科技公司,2016年以Precision IBD, Inc.注册成立,2019年更名为Prometheus Biosciences。该公司专注于研发和商业化炎症肠炎(IBD)的治疗和配套伴随诊断产品。2021年3月16日,公司完成了首次公开募股(IPO)。目前
雀巢为公司第一大股东,约10%。(截至2023年2月3日,公司股价$108.68/股,总市值约$50.42亿。)
▲Mark C. McKenna(主席兼CEO)
Mark C.McKenna在消费、医疗技术、制药和诊断领域拥有超过20年的工作经验。自2019年加入Prometheus以来,他为公司筹集了近5亿美元的股权资本,并领导了2021年表现最佳的生物技术IPO,创造了超过25亿美元的股权价值,为早期投资者带来了约20倍的回报。在此之前,McKenna先生是Bausch健康公司的高级管理人员,并担任子公司Salix Pharmaceuticals的总裁。在那里,他通过一系列的战略收购和产品发布振兴了胃肠病学业务,使收入翻了一番,超过20亿美元,同时提高了营业利润率。在早些时候,麦肯纳先生在Bausch + Lomb工作了十多年,担任过美国视力保健业务的高级副总裁和总经理,在那里他部署了超过1亿美元的战略投资,使一个原本成熟的市场实现了22%的收入复合增长率。他还曾在Johnson & Johnson担任过几个职务。麦肯纳先生拥有亚利桑那州立大学的市场营销学位,在Azusa太平洋大学获得了MBA学位,并且是沃顿商学院的一名研究员。
一、Prometheus360™平台
Prometheus拥有1个精准治疗药物平台,Prometheus360™,该平台包括了1个胃肠道(GI)生物信息学数据库,用于识别新的治疗靶标并开发候选药物,该数据库是世界上最大的GI数据库之一。同时,公司还在开发伴随诊断测试,旨在识别更可能对治疗药物产生反应的患者。
Prometheus360™平台包括临床数据库和相关的生物库,是全球最大的IBD和其他胃肠道疾病患者生物标本数据库之一。该数据库和生物库是从Cedars-Sinai Medical Center(Cedars-Sinai)独家授权获得,数据库中拥有超过20万个临床样本,来源于20年间收集的约2万例患者数据。数据包括了患者的电子医疗记录、影像信息、临床生化、病理记录和血清学数据。生物库中的患者样本,则包括组织活检(来自内镜检查或手术)、血清/血浆、DNA、RNA、外周血单核细胞(PBMC)、固有层单核细胞(LPMC)、粪便和肠系膜脂肪组织。
此外,Prometheus360™整合了数据挖掘和生物分析功能,利用这些功能发现有关驱动IBD的免疫途径的洞察,同时提供有关潜在靶标生物学的整体视图。公司将机器学习算法应用到临床数据和分子谱数据上,揭示与疾病相关的趋势、模式和关联,以反映IBD等复杂疾病在分子水平发生的变化Prometheus相信将数据结合最新的机器学习算法,Prometheus360™成为公司研发的驱动力。
二、关于Prometheus-PRA023
据药融云数据库显示,
PRA023是一种
IgG1人源化单克隆抗体,可阻断TNF类配体1A(TL1A)。PRA023对人TL1A具有高亲和力和特异性,主要用于治疗溃疡性结肠炎(UC)、克罗恩病和系统性硬化症相关的间质性肺部疾病(SSc-ILD)。2022年12月7日Prometheus公布PRA023治疗溃疡性结肠炎和克罗恩病获Ⅱ期积极结果。
药物基本信息(部分)(微信搜索"药融云小程序"进行相关更多数据查询)
截图来源:药融云全球药物研发数据库
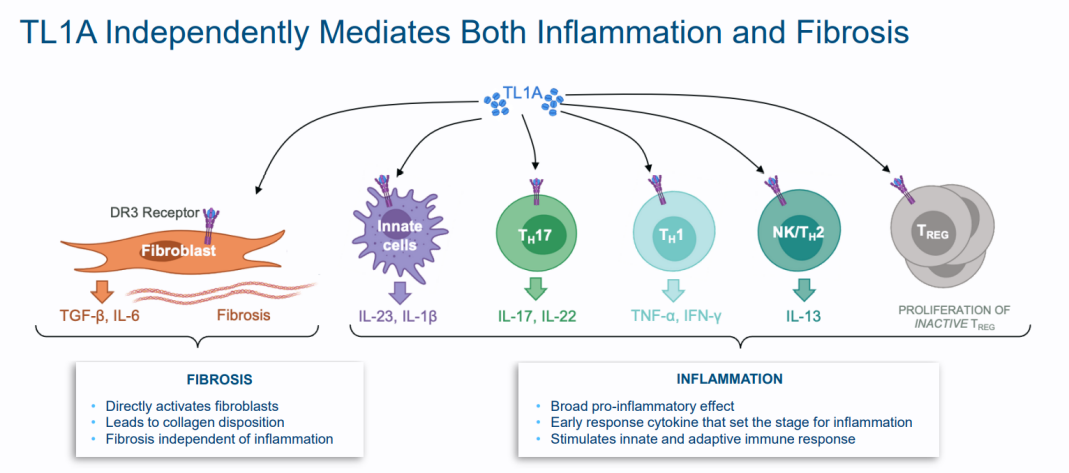
TL1A是Prometheus Biosciences创始人发现的一个创新炎症性肠病靶点。TNF配体相关分子1A(TL1A)属TNF超家族成员,能够介导炎症和纤维化,是肠道炎症的关键介质。它在介导炎症和纤维化方面具有多重作用,并且与多种免疫和纤维化疾病相关。PRA023可以与可溶性或细胞膜结合的TL1A特异性结合,具有显著改变那些TL1A表达水平升高的IBD患者病情的潜力。
▲TL1A介导炎症和纤维化的机制
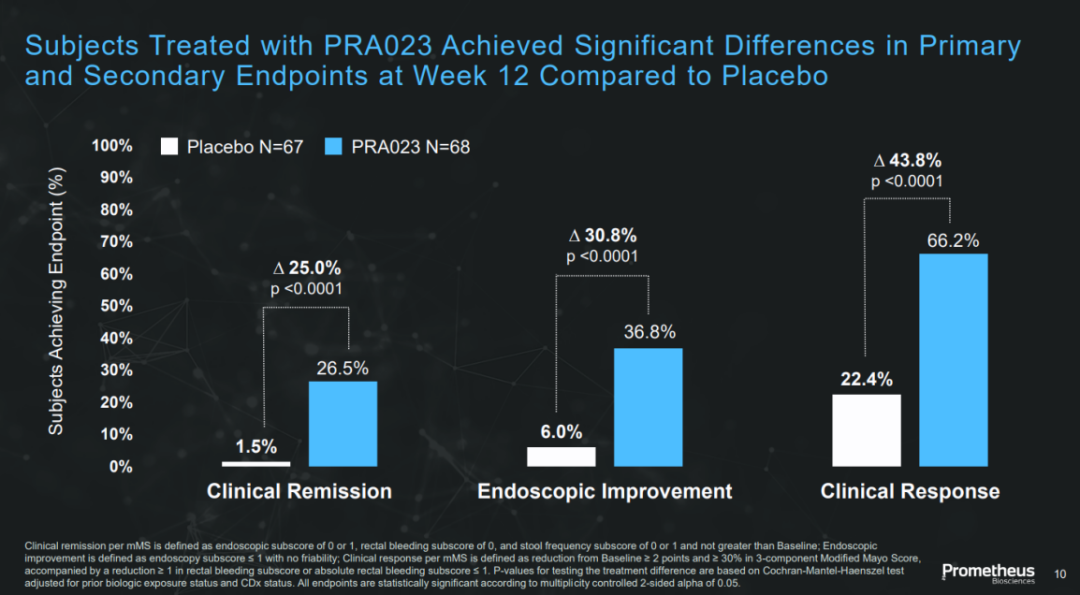
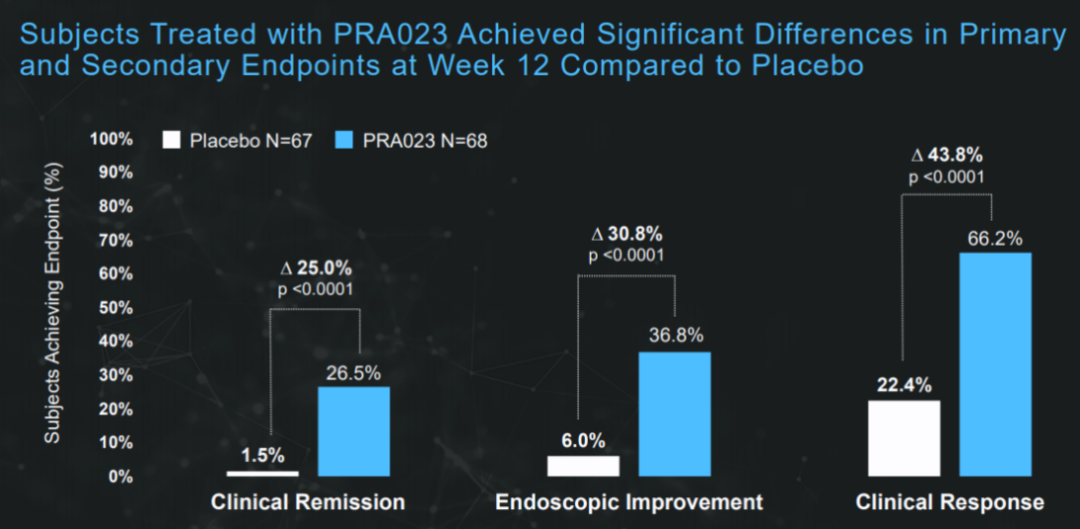
在治疗中重度溃疡性结肠炎的随机双盲Ⅱ期临床试验中,PRA023达到主要终点。12周治疗后,PRA023组中26.5%的患者达到临床缓解的主要终点,对照组这一数值为1.5%(p<0.0001)。PRA023组中36.8%的患者达到内窥镜改善的次要终点,安慰剂组的数值为6.0%(p<0.0001)。
在治疗中重度活动性克罗恩病患者的开放标签Ⅱa期临床试验中,PRA023组中26.0%获得内窥镜缓解,与预先确定的历史安慰剂组缓解率(12%)相比达到统计显著水平(p=0.002)。PRA023组中49.1%的患者获得临床缓解,与预先确定的历史安慰剂组缓解率(16%)相比达到统计显著水平(p<0.001)。
ARTEMIS-UC 2期
该项研究旨在评估PRA023对常规或先前治疗失败的中重度活动性UC患者的疗效和安全性。Cohort1达到了主要和所有排名靠前的次要终点,包括临床、内窥镜、组织学和患者报告的结果指标。PRA023组100%患者完成Cohort 1研究。PRA023组主要终点临床缓解率为26.5%,安慰剂组仅1.5%;次要终点经安慰剂调整的内窥镜改善率为30.8%。
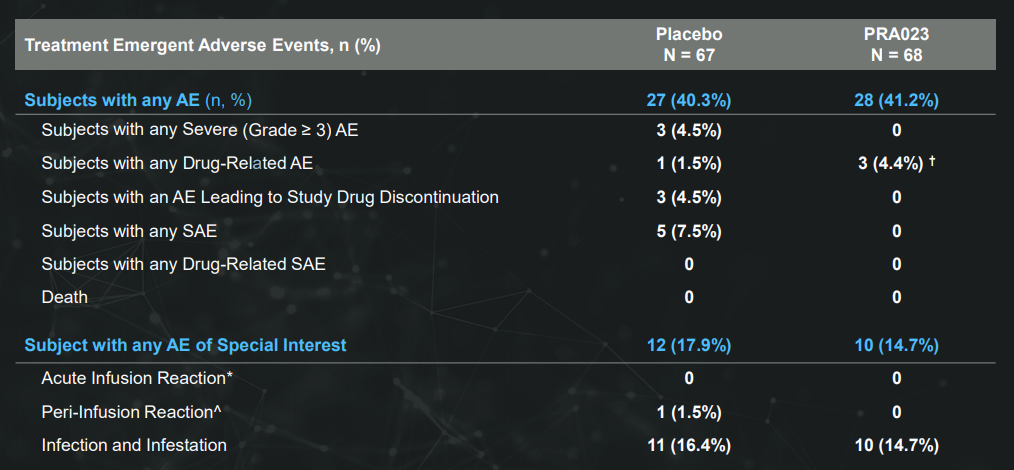
安全性上,PRA023组没有治疗产生的严重不良事件(SAE)、AE、严重AE、机会性感染或输液反应的报告。与安慰剂相比,PRA023组唯一发生在两个以上患者身上且频率较高的AE是COVID-19(分别为5/68 [7.4%] 和3/67 [4.5%])。
APOLLO-CD 2a期
该项研究旨在评估在常规或生物制剂治疗失败的中重度活动性克罗恩病参与者中的安全性和有效性。PRA023组临床缓解率49.1%(VS安慰剂16%)。耐受良好,无SAE和药物相关AE。PRA023针对UC和CD的3期研究预计今年-2023年开展。
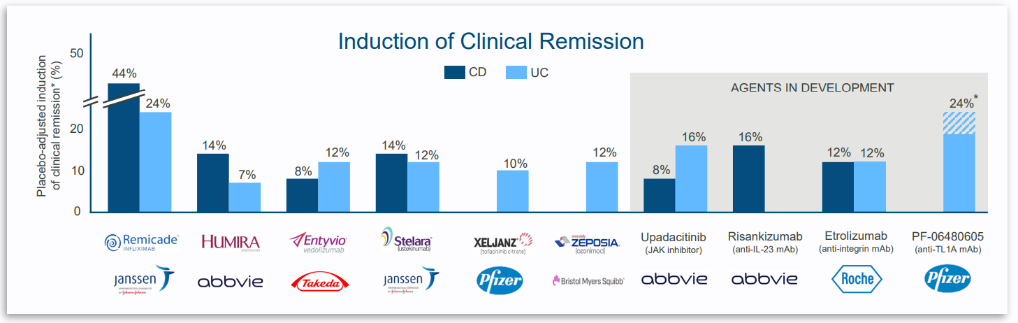
总结来看,PRA023在UC和CD治疗中都展现了优异的疗效和安全性。其中治疗UC的药物临床缓解率多处于10-15%,而PRA023可达到25%,PRA023具有成为同类最优的潜力。“我们对这些研究结果和它们对IBD患者的意义感到非常兴奋。PRA023在溃疡性结肠炎和克罗恩病患者中的表现超出我们的预期。”Prometheus Biosciences主席兼CEO Mark McKenna先生说,“我们相信PRA023和我们的精准医药策略具有改变IBD治疗模式的潜力。我们期待与监管机构进行讨论,并准备启动3期临床研究。”
此前2022年12月1日,辉瑞宣布与Roivant合资成立Vant公司,专注于TL1A单抗RVT-3101(PF-06480605)在UC及其他炎症和纤维化疾病中的开发和商业化。
关于辉瑞RVT-3101
RVT-3101是一种
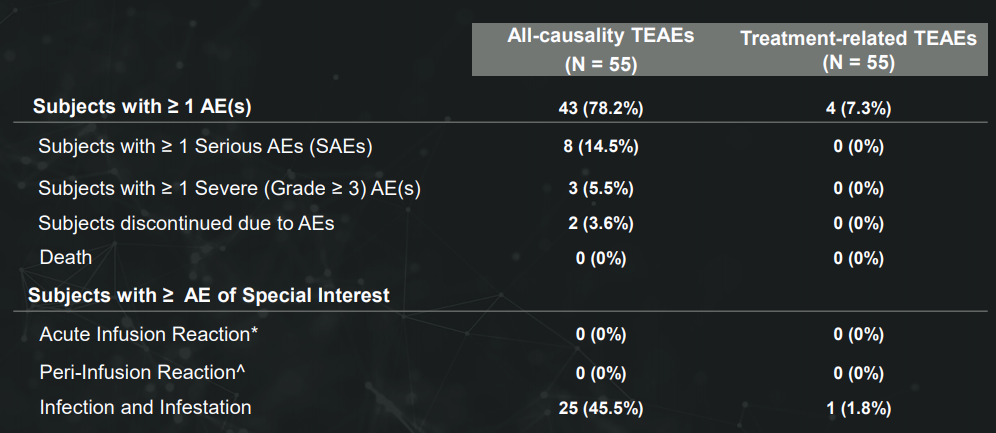
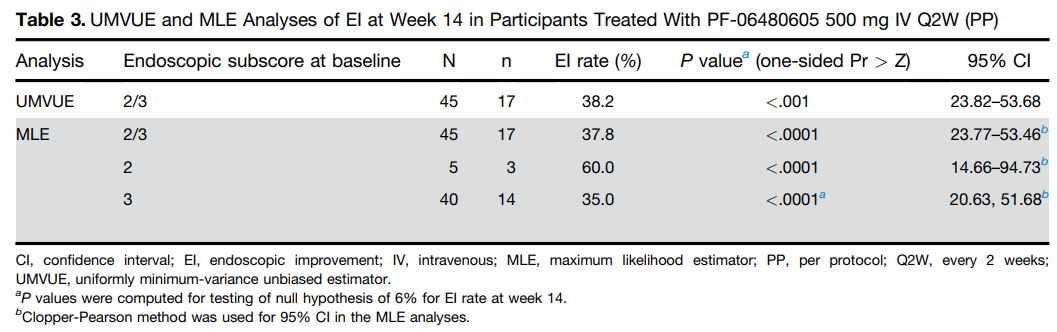
针对TL1A的全人类单克隆抗体,目前正处于溃疡性结肠炎(UC)的大型全球2b期临床中。此前公布的2a期试验中,最常见的AE是UC疾病加重和关节痛(各6人),有4个严重的AEs,没有死亡。第14周,内窥镜改善率(EI)为38.2%。
RVT-3101针对溃疡性结肠炎的全球研发现状(部分)
截图来源:药融云全球药物研发数据库
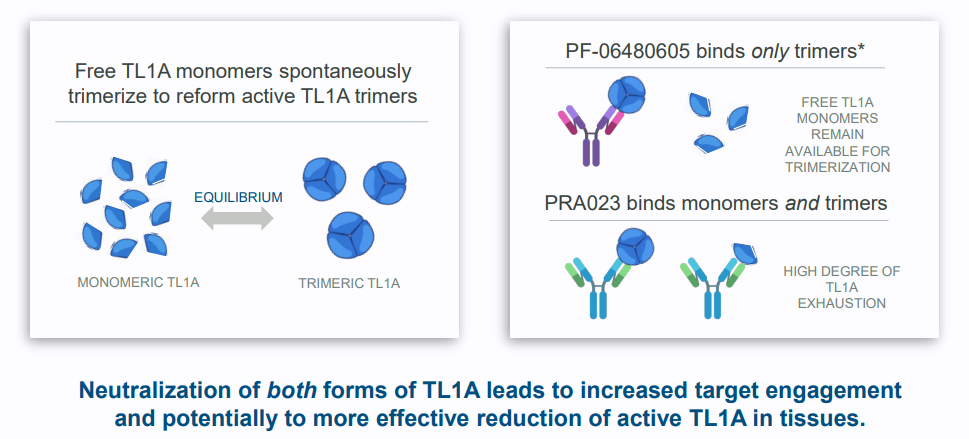
PRA023与辉瑞TL1A药物不同之处在于,PRA023能有效结合和中和TL1A的活性三聚体形式和非活性单体形式,以实现更稳定的靶标结合。
三、财务表现
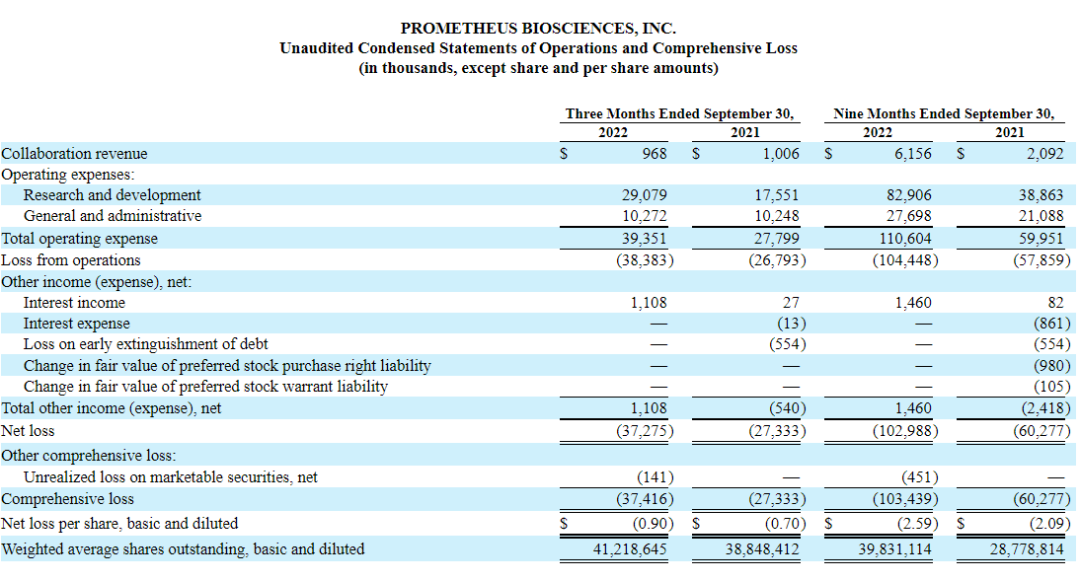
01.2022年三季度报
2022年11月09日,Prometheus公告称,2022财年前三季度收入615.6万美元,去年同期收入为209.2万美元,同比增长194.26%;2022财年前三季度净亏损1.03亿美元,去年同期净亏损为6027.7万美元;基本每股收益为-2.59美元,去年同期为-2.09美元。
截至2022年9月30日,Prometheus公司现有总资产2.99亿美元,去年同期这一数值为2.68亿美元。
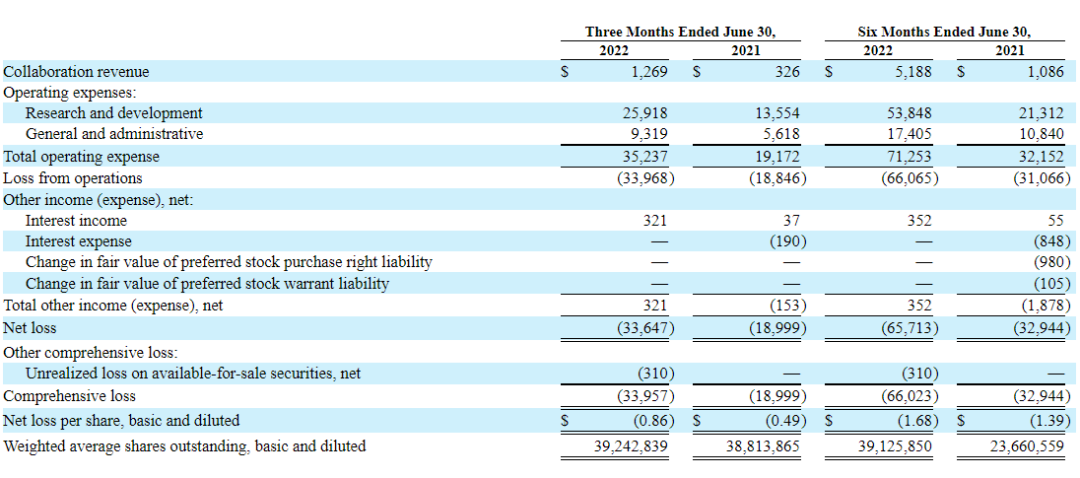
02.2022年中报
2022年8月11日Prometheus公布财报2022财年中报归属于母公司普通股股东净利润为-6571.3万美元,同比下降99.47%;营业收入为518.8万美元,同比上涨377.72%。
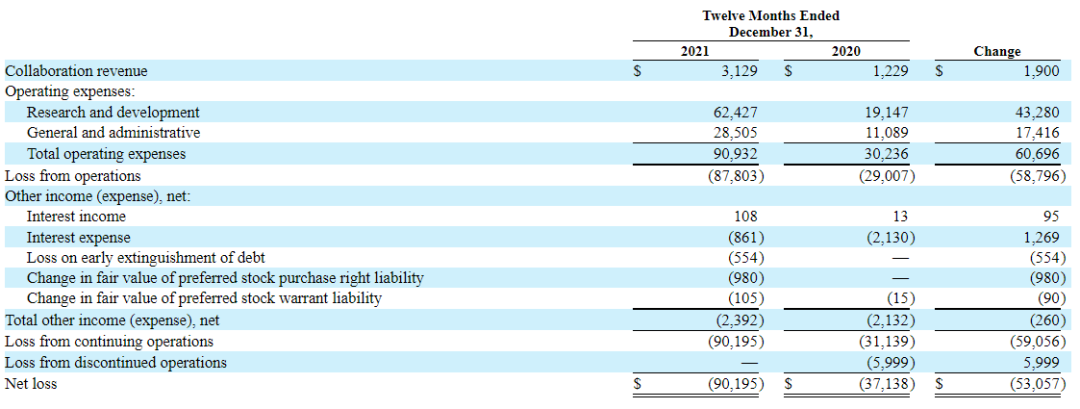
03.2021年年报
2022年3月9日,Prometheus公布2021财年年报,公告显示2021全年公司营业收入为312.9万美元,而2020年度收入为122.9万美元,同比上涨154.6%,主要是由于与Falk合作的PR600项目的开发活动增加。2021年归属于母公司普通股股东净利润为-9019.5万美元,同比下降142.86%。
2021年研发费用按候选产品划分(以千计):
2021财年公司研发费用为6242.7万美元,而2020年研发费用为1914.7万美元,增加了4330万美元。
主要是由于:(1)PRA023的1a期临床试验和启动PRA023的全球2期临床试验相关的临床试验费用增加了1340万美元;(2)与支持PRA023的临床试验和PR600的pre-IND活动的合同制造活动有关的费用增加了930万美元;(3)与人员费用有关的支出增加了680万美元,以支持更多的开发和临床试验活动;(4)与Enroll360平台有关的支出增加了220万美元,与PRA023在SSc-ILD中的2期临床试验的启动活动有关的支出增加了210万美元;(5)其他临床前开发项目和两个主要目标PRA023和PR600有关的持续开发活动的支出。
四、在研产品管线
五、IBD和市场机会概述
炎症性肠病(IBD)是一种慢性复发性和缓解性胃肠道炎症性疾病,它是一种复杂的疾病,有许多影响因素,包括遗传、环境和免疫。炎症性肠病通常在青春期和青年期发病,根据临床、实验室检查、内窥镜检查和组织病理学和/或影像学检查结果进行诊断。2019年,IBD市场在美国约为125亿美元,全球约为184亿美元,预计到2024年,美国IBD市场体量将增长至约142亿美元,全球将增长至214亿美元。
UC和CD是两种最常见的IBD类型。UC导致消化道长期炎症和溃疡,并影响大肠(结肠)和直肠的最内层。溃疡性结肠炎使人虚弱,并可能导致危及生命的并发症,与UC相关的慢性炎症还会增加患者患结肠癌的风险。据估计,UC在美国影响了92.6万人,在全球影响了275万人。2019年,UC市场在美国约为42亿美元,全球约为62亿美元,预计到2024年,美国UC市场体量将增长至约54亿美元,全球将增长至83亿美元。
CD还会引起消化道的长期炎症和溃疡。它与UC的不同之处在于它影响肠壁的整个厚度和从口腔到肛门的消化道的所有部分。据估计,CD在美国影响了115.7万人,在全球影响了244.6万人。消化道异常狭窄的发展较为常见,并且是需要手术干预的主要适应症。高达70%的CD患者出现消化道异常狭窄或穿孔并发症,在过去十年中,抗炎药的使用并没有实质性地改变因狭窄疾病而需要手术切除的比率。2019年,CD市场在美国约为84亿美元,全球约为122亿美元,预计到2024年,美国CD市场体量将增长到约88亿美元,全球将增长到131亿美元。
六、目前炎症性肠病(IBD)的治疗局限性
自1998年首个用于治疗CD的抗TNFa药物获得批准以来,JAK抑制剂(在UC中)和新的生物制剂(包括抗整合素和抗IL12/23)的可用性改善了中度至重度IBD的治疗,但这些都是抗炎药,由于其对胃肠道外免疫系统的全身影响和由此产生的影响,因此具有安全性和耐受性问题。特别是在2021年底,FDA对JAK抑制剂类药物发出了黑框警告,该药物用于治疗关节炎和其他炎症,因为它会增加严重心脏相关事件(如心脏病发作或中风、癌症、血栓和死亡)的风险。
目前对炎症性肠病的治疗采用“一刀切”的方法,不考虑患者的遗传或生物学变异。Prometheus Biosciences认为,必须进行范式转变,为那些疾病由特定生物学驱动的患者开发特定疗法。到目前为止还没有临床阶段的项目专注于将精确治疗与伴随诊断相结合,以克服IBD “一刀切”治疗方法的局限性。此外,尽管在过去二十年中,治疗UC和CD的抗炎疗法取得了进展,但这些患者的纤维化在很大程度上没有得到治疗,这是一个高度未满足需求的领域。
从公开资料来看,目前TL1A靶向药仅Prometheus和辉瑞挺进临床二期,除这两款药物外,尚无药物进入临床,也就是说,在TL1A赛道上,Prometheus和辉瑞正在参加双人赛跑。Roivant公司首席执行官Matt Gline对此表示:“这不是我们与Prometheus的竞争,而是我们与这个疾病领域的竞争。”
参考:
NMPA/CDE;
药融云数据,vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
https://www.prometheusbiosciences.com
https://www.sec.gov/Archives/edgar/data/1718852/000156459022009321/rxdx-10k_20211231.htm
https://mp.weixin.qq.com/s/iOdKPYjds4D1s1BlZ0ligw
https://www.prometheusbiosciences.com/prometheus360
https://www.prometheusbiosciences.com/pipeline/pra023/
TL1A/
https://ir.prometheusbiosciences.com/news-releases/news-release-details/
Prometheus-biosciences-announces-positive-results-pra023-both
谢小萌,何琼《英夫利昔单抗治疗
炎症性肠病的研究进展》,Journal of Modern Clinical Medicine, Vol.48 No.6, Dec.2022
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
<END>




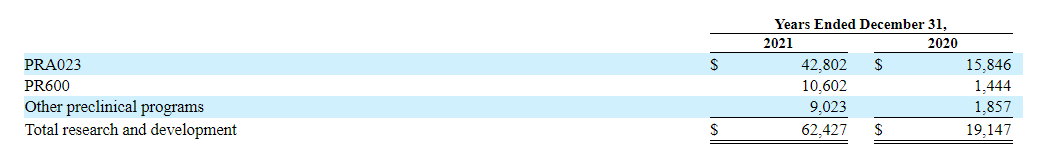

















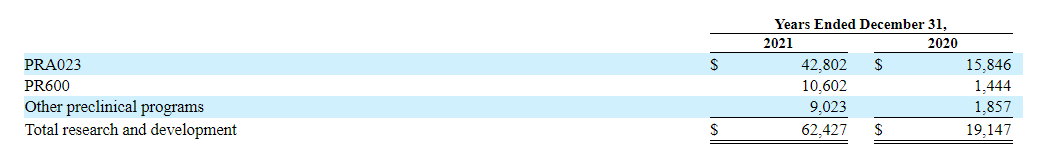




收藏
登录后参与评论