最近做的几个口服固体制剂的项目,都用到滴定分析,发现有些人对滴定分析方法的开发和验证还不是特别了解,在这里我简单把自己的经验总结了一下。
我们在高中就学过四大滴定:酸碱滴定法、络合滴定法、氧化还原滴定法、沉淀滴定法。滴定法的优点是操作简单,准确度高,重复性好,能定量分析,对仪器的要求不高,便于推广。缺点是在药物分析这块来讲,不如液相和气相一样能够很直观的进行审计追踪,不过随着科技的发展,有些能够实行审计追踪,有些仪器譬如梅特勒自动电位滴定仪(如V30)能自动滴定,配备自动的小型打印机,能即时记录消耗滴定液的体积,现在很多药厂或者研发机构的电子天平也都配备小型打印机,或者进一步来讲的话,录像也是一个可以审计追踪的方法,不过录像的普及还是需要一个很长的道路要走。
言归正传,说说制剂研发的思路。
一:分析方法的开发:
首先我们需要进行文献调研,对文献方法的一个重复,但是也不一定得完全采用文献的方法,需要根据自己项目的实际情况进行对比优化。又或者文献资料并不是我们所要的资料,譬如做的项目是复方聚乙二醇电解质散(儿童型),但是目前国内外没有查到相关的分析方面的文献,但是查到了复方聚乙二醇电解质散(Ⅱ)和复方聚乙二醇电解质散(Ⅲ)的参考文献,虽然处方组成及配比不同,但是有些处方种类是近似的,因此就需要根据文献对比检测方法,然后进行优化。
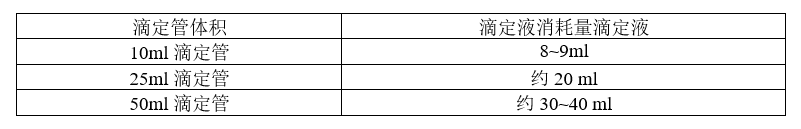
1:滴定管的选择
消耗滴定液消耗的体积及滴定管的选择是很重要的指标,为什么我们选定的分析需要消耗滴定液最低8ml起步呢:
这个通过一个简单的换算就可以知道:药典上1毫升相当于20滴,一滴也就是0.05ml。我们按照半滴0.02毫升计算。咱们来看消耗半滴的量的检测的误差
滴定法误差计算:
从结果来看,滴定体积越大,重复性及准确就越高,检测误差越小。
2:滴定剂的浓度的选择
我们是做药物分析的,一般我选择中国药典上收载的滴定剂浓度,不进行调整或更改,这样保证滴定液的使用有来源。譬如盐酸滴定液,药典上有如下滴定液的配置(1mol/L、0.5mol/L、0.2mol/L、0.1mol/L),并且药典上也明确说,如果需要盐酸滴定液(0.05mol/L、0.02mol/L、0.01mol/L)时,可取盐酸滴定液(1mol/L或0.1mol/L)加水稀释制成。必要时标定浓度。假如由于滴定剂的浓度的选择,导致消耗的体积不是我们需要的体积时,简单来讲,以上药典上收载的滴定液的浓度依然达不到我想要的结果,就可以调整样品的称量,也可以调整移液的体积增加或者减少检测样品的浓度,以与滴定液的消耗体积进行匹配。
二、分析方法的验证
分析方法确定后,需要进行分析方法的验证。
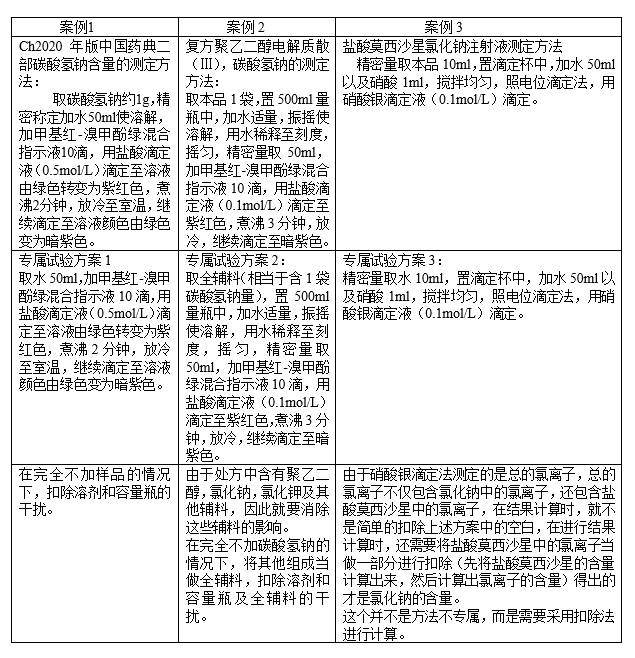
1、首先做专属性试验,专属试验的目的,是为了证明空白溶剂或者辅料等不干扰样品的测定,或者干扰了不得过2.0%。如果是对于原料的检测的话, 其中空白是在不加样品的情况下,按照同法进行操作所得的结果。制剂的空白指的是除了被测成分,其他全是全辅料,以3个不同剂型案例,告诉大家不同的样品,怎样做专属试验。
2、线性试验:应该在设计的范围内测定线下关系,一般液相或气相的线性可以用同一贮备液逐步稀释,也可以分别称取对照品,制备一系列的浓度,是要求至少制备5份不同浓度水平,进行线性回归,但是容量法的线性,《欧洲药典质量标准的起草技术指南》2005年版,明确提出对至少7份不同重量的供试品进行滴定。滴定终点消耗的滴定液体积应为所用滴定管体积的20~90%。
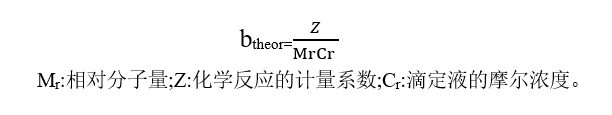
通过线性回归方程对依赖于供试品重量(m)的滴定终点体积(v)进行评价,获得线性回归方程并用斜率进行表示(bobs),通过与理论(给定的滴定常数)斜率(btheor)之间的偏差进行判断。
对于电位滴定法,测定的值与理论值的相对偏差不得过0.3%,采用指示剂法,相对偏差不得过0.5%。
3、准确度:分别配制浓度为80%、100%和120%(如制剂需要测定含量均匀度,应为测试浓度的70%、100%和130%)的供试品溶液各3份,分别测定其含量,将实测值与理论值比较,计算回收率。这个要求和液相或者气相的要求是一致的,但是这里需要强调一点的是,我们常规的方法一般是称取一定的固体标准品和全辅料,同含量的配制方法进行回收试验,但是有的比较特殊,譬如,盐酸莫西沙星氯化钠注射液项目,称取氯化钠对照品和盐酸莫西沙星对照品置量瓶中,由于同离子效应,导致盐酸莫西沙星原料不能完全溶解,因此需要模仿制剂工艺,先将盐酸莫西沙星溶解,然后加入氯化钠溶液的方式进行回收试验,因此具体的项目需要根据具体情况具体分析。
4、重复性:制剂中含量的重复性和液相及气相色谱一样,通过平行配制6份样品,所得含量的结果的RSD进行验证,这个就不需要过多解释。
5、溶液稳定性考察:关于容量法溶液稳定性考察,一般不需要做,因为对于操作简单,反应灵敏的滴定法,配置完样品一般也都很快测了,不会放置太长时间。除非有特别情况。
相关阅读:
参考文献
[1]2020年版《中国药典》四部
分析方法验证指导原则(9101)
[2]欧洲药典质量标准的起草技术指南(2005)
<END>







收藏
登录后参与评论