肽,影响着生物体内许多重要的生理、生化功能。
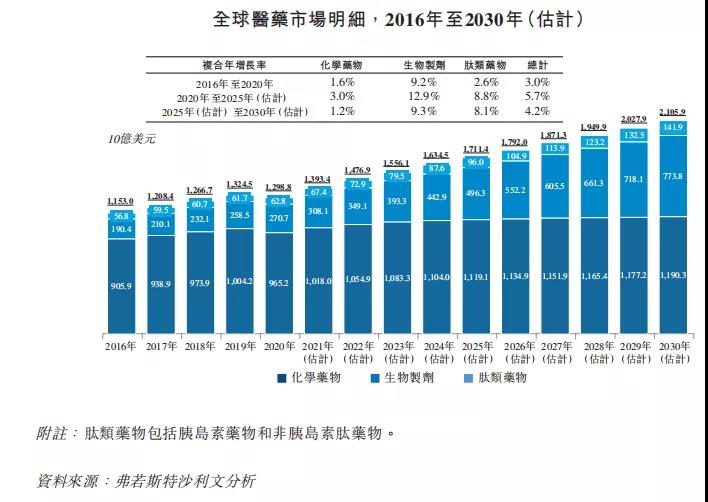
数据显示,2020年全球多肽类药物市场达到628亿美元,预计于2025年将进一步增加332亿美元到960亿美元,2020年至2025年的复合年增长率为8.8%。根据弗若斯特沙利文的资料,尽管以目前的销售收入计,多肽类药物市场仅佔全球药物市场总量的一小部分,但多肽是增长第二快的药物类别,且预计其市场规模于2030年将达到1419亿美元。
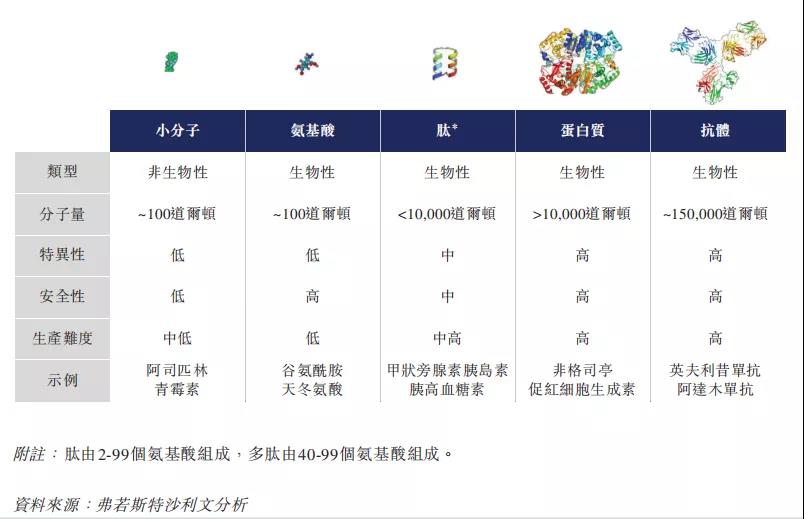
肽作为一种独特的药物化合物,分子介于小分子与蛋白质之间,但在生化及治疗上有所不同,肽为密切模仿自然路径的治疗性干预提供机会,并在人体的多种生理过程(包括激素、神经递质)或在炎症反应中发挥主要作用。。多肽不仅可以天然提取也可以进行人工合成,其凭借纯度高和质量可控等多重优势成为当前的热门药物,小分子药物很少有多肽那样具有选择性强和起效快的特点。
肽疗法因其复杂性及与蛋白质生物制药相似的特性,一般具有较高的进入壁垒。另一方面,与蛋白质生物制药相比,生产成本通常较低及产量通常较高。因此,全球许多生物技术公司和制药公司都争相进入多肽药物赛道,多肽药物市场逐渐进入上升发展期此外,多肽类因为具有短暂的半衰期,因此在人体内的清除速度非常快,具有低剂量、低毒性的特点。
按2020年的收入计,收入排名前四的肽CDMO公司约占全球肽CDMO市场的40.1%,而昂博制药作为世界上最大的多肽生产厂家之一,在全球肽CDMO市场中排名第四。
2021年6月25日,昂博制药( Ambio Pharmaceuticals)向港交所递交招股书,拟在中国香港主板挂牌上市,伴随着市场需求的日益发展,登陆港股后的昂博制药可能将会迎来更大的发展潜力。
昂博制药成立于2005年,是全球四大肽类药物CDMO之一,专注于肽开发及生产,目前已经成功研发出各类多肽新药。根据公司相关披露,截至2020年12月31日,公司已为全球客户提供了200多个新药NCE项目。公司拥有一支由500多名肽类专家、化学家及行业专业人员组成的专责团队,并在美国南卡罗来纳州北奥古斯塔及中国上海建有实验室和生产设施,目前公司已服务多元化且强大的客户群,涵盖前景广阔的早期生物技术公司以及全球领先的制药及生物技术公司。
一、进攻糖尿病领域,自主开发多肽药物
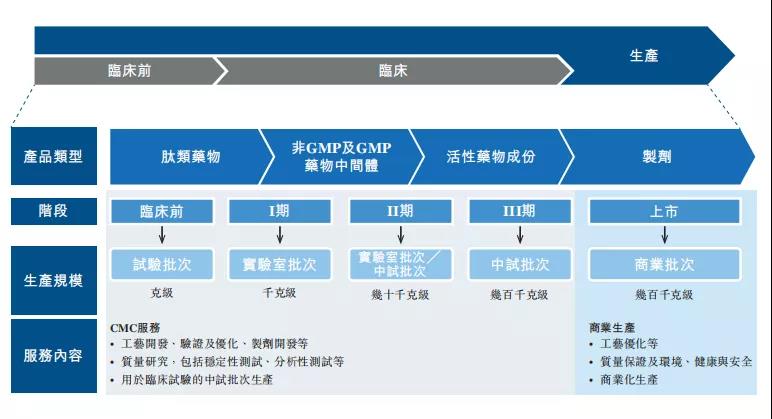
(多肽CDMO业务流程)
除了CDMO业务,2012年起昂博制药启动了肽类药物的开发,主要包括以下三类:复杂多肽类仿制药;缓释多肽类药物;GLP-1及胰岛素类药物。
2020年全球抗糖尿病药物市场达到697亿美元,2016年至2020年的复合年增长率为3.7%。随着糖尿病的流行及胰岛素药物的广泛采用,市场将继续增长,正是由于糖尿病领域的庞大市场规模和依然未被满足的患者临床需求,昂博制药在正式启动肽类药物自主开发之后便决定利用公司自身专业的生产知识建立糖尿病平台。所研产品包括使用化学合成胰岛素技术方面的先发优势,开发每周注射的第四代胰岛素类似物。
此外,昂博制药与部分世界领先的制药公司以及生物类似药及仿制药公司建立战略合作伙伴关系以合作开发管线中的若干肽类药物,并使用合作公司的名义就该产品向FDA提交6项ANDA。他们已与两家全球制药公司订立开发及分销协议,以在欧洲注册及分销利拉鲁肽仿制药。同时,公司完成了索马鲁肽三个申报批次的生产,并计划在2021年底前就索马鲁肽(Semaglutide,司美格鲁肽)药物向FDA提交ANDA。
二、经营状况
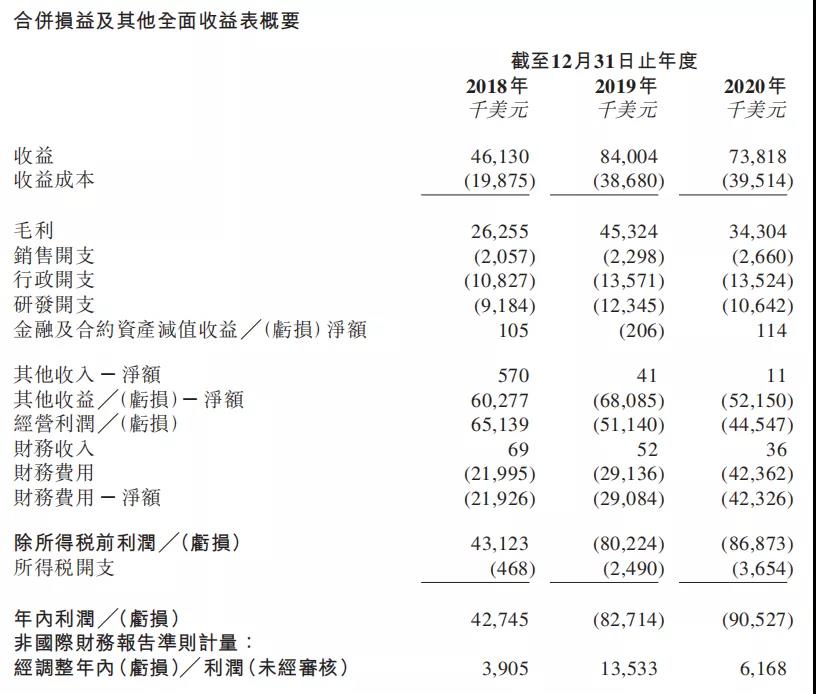
(2020年公司全年业绩)
据昂博制药招股书显示,受新冠疫情影响公司产品使用率大幅下降,因此2020全年整体收益比去年减少12.1%至7381万美元,年内净利润约亏损9053万美元,主要是由于与可转换可赎回优先股有关的衍生工具公平值亏损所致,同时疫情导致的销售收益预估减少约1200万美元至1500万美元。
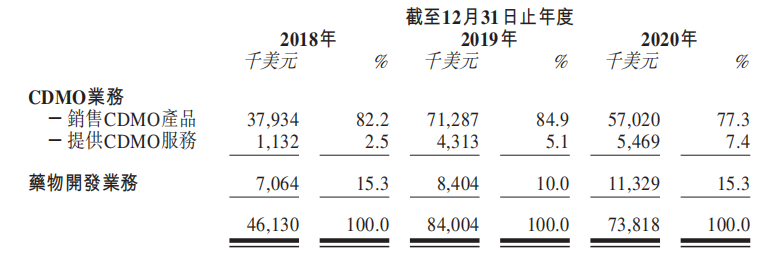
(2020年公司各业务收益,来自公司招股书)
2018年、2019年及2020年,昂博制药的多肽类CDMO服务产生的收益分别为3910万美元、7560万美元及7380万美元;占同期收益的84.8%、90.0%及84.7%在2018年、2019年及2020年,公司的肽类药物开发业务产生的收益分别为7.06亿美元、840万美元以及1133万美元,按26.2%的复合年增长率增长,能够在产品获批及商业化前降低开发成本,使在研产品获批及商业化后仍具巨大的利润增长潜力。
截至2020年12月31日止年度,位于北美、亚洲、欧洲及其他国家的CDMO客户分别约占公司收益62.5%、26.2%、10.3%及1.0%。
三、研发管线
昂博制药选择与部分世界领先的制药公司以及领先生物类似药(biosimilar)及仿制药(generic)公司建立战略合作伙伴关系,合作开发管线中的若干多肽类药物。
目前昂博制药的产品管线中有12种在研肽类药物,其中5种是仿制多肽类药物,5种是GLP-1及胰岛素类药物及3种缓释肽类药物。
产品管线中近期上市的若干主要产品包括:
特立帕肽,为Forteo®的生物等效肽类药物,Forteo®是用于治疗骨质疏松症的合成甲状旁腺激素(PTH)。预期于短期内就该在研产品将获得FDA及EMA批准。
替度鲁肽,为Gattex®的生物等效肽类药物,Gattex®为用于治疗短肠综合症(SBS)的处方药。预计将于2023年获得FDA批准Gattex®的生物等效药,并在不久后在原研方的相关专利到期前上市该在研产品。
利拉鲁肽,为Victoza ®的生物等效肽类药物。Victoza® 是由Novo Nordisk开发的GLP-1激动剂,用于治疗2型糖尿病。预计将于2024年前获得相关FDA批准。
就生物等效肽类药物而言,已连同合作伙伴以彼等名义向FDA提交6 项ANDA、向EMA提交2份申报文件、向CFIA提交1份申报文件并有逾15项其他国际申请。
2020年,有288个处于不同研发阶段的多肽项目正在进行中,其中266个处于临床前及I期临床试验阶段、16个处于II期临床试验阶段、2个处于III期临床试验阶段及4个已商业化。
四、竞争优势
多肽是α-氨基酸以肽键连接在一起而形成的化合物,也是蛋白质水解的中间产物。作为世界上最大的定制肽生产商之一,公司能生产客户所要求的几乎任何种类的肽,包括经特殊修饰的肽,为此公司主要分化成两种经营模式——CDMO业务和自主开发。
(昂博制药中美工厂,来源于官网)
为企业定制各类多肽服务
通过成熟的公司平台和技术制造固相、液相、混合多肽化药,其多肽开发服务贯穿临床前研究到商业开发再到规模化和过程认证,最后是食品药品监督管理局(FDA)新药上市申请(NDA)前过程验证整个流程,并遵守FDA对多肽制造规定的现行药品生产质量管理规范(cGMP)。除了专利多肽原料药的生产,还为成熟的商业市场生产仿制药和为临床研究实验室生产非GMP多肽。
低成本,高质量
昂博制药开发并扩大了在研肽类缓释制剂候选药物的生产规模。独特的商业模式使得公司有能力以比大多数竞争对手更低的价格生产任何规模的高质量产品,同时优越的化学技术和设备使他们能够提供一流的产品质量和合理的生产成本。
(来源于公司官网)
快速流程
据招股书显示,截至2020年12月31日,公司在美国及中国运营16条肽生产线,成为了全世界最大的cGMP肽生产公司之一。设施配备了1,000升的固相反应器及5,000升的液相反应器,使公司每年能通过美国及中国工厂合共生产逾300千克的肽原料药。昂博制药可交付经由公司内部质量控制小组检查并通过的定制多肽,最短只需要用3-4周的时间。
中美工厂优势明显
在美国的位于南卡罗莱纳州北奥古斯塔的工厂总建筑面积约为82,566平方,主要负责肽CDMO业务的纯化及质量保证与控制,以及在研肽类生物等效药产品及在研肽类生物类似药产品的研发。截至2020年12月31日,美国工厂拥有10条肽纯化生产线,其设备规格介乎20厘米至100厘米不等,使他们每年可生产300千克以上的成品肽。
至于中国的工厂则是位于上海,主要负责大规模生产粗肽,以运往美国设施作进一步纯化。截至2020年12月31日,中国工厂拥有71个规格介乎20升至5,000升的反应器,及6条肽纯化生产线,其设备规格介乎8厘米至45厘米。
五、发展历程
2007年,运营从事多肽CDMO业务的主要经营附属公司AmbioPharm, Inc.和上海昂博生物技术有限公司。
2011年,创立从事多肽药物产品开发的附属公司Ambio, Inc。
2014年,完成A系列融资,共筹募2400万美元。完成重组,Ambio Holdings, Inc.分别成为
CDMO业务及肽类药物开发业务的主要经营附属公司AmbioPharm, Inc.及Ambio, Inc.的当时控股股东。
2015年,与全球领先的医药生物仿制药公司Apotex订立开发、供应及分销协议,为期20年;Bivalirudin API于12月获FDA批准商业供应。
2018年,完成A-2系列融资,并筹募2000万美元。
2020年,与Apotex合作已于5月获得加拿大CFIA的批准特立帕肽药物(teriparatide)与礼来(Eli Lilly)的特立帕肽(Forteo)仿制药。同时完成B系列融资,并筹募8000万美元。
六、结语
昂博制药可以提供涵盖整个肽生产及开发过程的综合服务,以及具有低成本的方式开发和生产难以制造的肽并满足严格的各国监管机构法规批准规定的能力。此外,公司专业的技术专家团队使他们有足够的能力研发出各类市场需求的肽类产品,利用本身在市场的地位和技术优势保持足够的竞争力。
与传统药物相比,新兴技术药物自然更具优势,多肽也不例外,随着市场需求的日益增长,各企业也在技术方面飞速进步,今后或将会迎来更多符合市场要求以满足患者临床需求的多肽药物。















收藏
登录后参与评论