地中海贫血主要分为α、β、δ、γ4种亚型,其中前两种亚型在临床较常见。β-地中海贫血(Beta thalassemia,简称:β-地贫)是常见的可遗传溶血性单基因疾病,其致病机制主要为β-珠蛋白基因缺失或突变导致β-珠蛋白生成障碍而引发溶血性贫血。临床上将其分为轻型、中间型和重型三种,重型β-地贫有严重的致死性。
β-地贫表现出非常典型的区域性分布:全球范围内大约有8000~9000 万人为携带者,发病率最高的是地中海区域、中东和东南亚(特别是印度、泰国和印度尼西亚,约占总体受影响出生数的 50%)。我国整体人群β -地贫的患病率为 0.67%,而在南方地区(广东,广西,福建,湖南,云南,贵州,四川等) 高发,平均患病率为 2%。“规范性终身输血”一直很难保证,反复输血带来的短期和长期风险也不容忽视。频繁输血有并发输血相关病毒感染的风险;长期输血可引起铁过载,铁沉积于心脏、 肝脏等器官,可导致心功能衰竭、 肝硬化等,最终引起死亡。
药融圈旗下,药融云数据(https://www.pharnexcloud.com/?zmt-mhwz)显示:
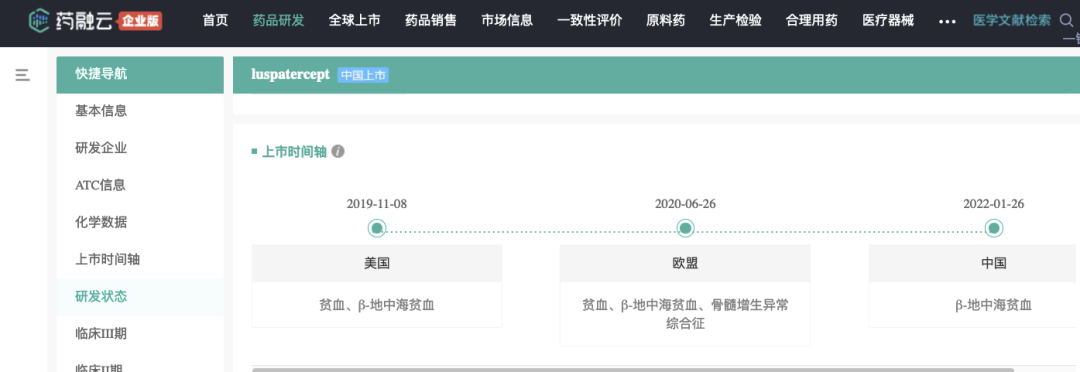
2022年1月,我国NMPA批准
全球首个且唯一的红细胞成熟剂注射用罗特西普(Luspatercept for Injection,商品名:利布洛泽)上市,用于治疗需要定期输注红细胞且红细胞输注≤15单位/24周的β-地中海贫血成人患者。这是10多年来我国
首个获批治疗地贫的创新药物。
罗特西普批文信息
截图来源:药融云中国药品批文数据库
罗特西普上市时间轴
截图来源:药融云全球药物研发数据库
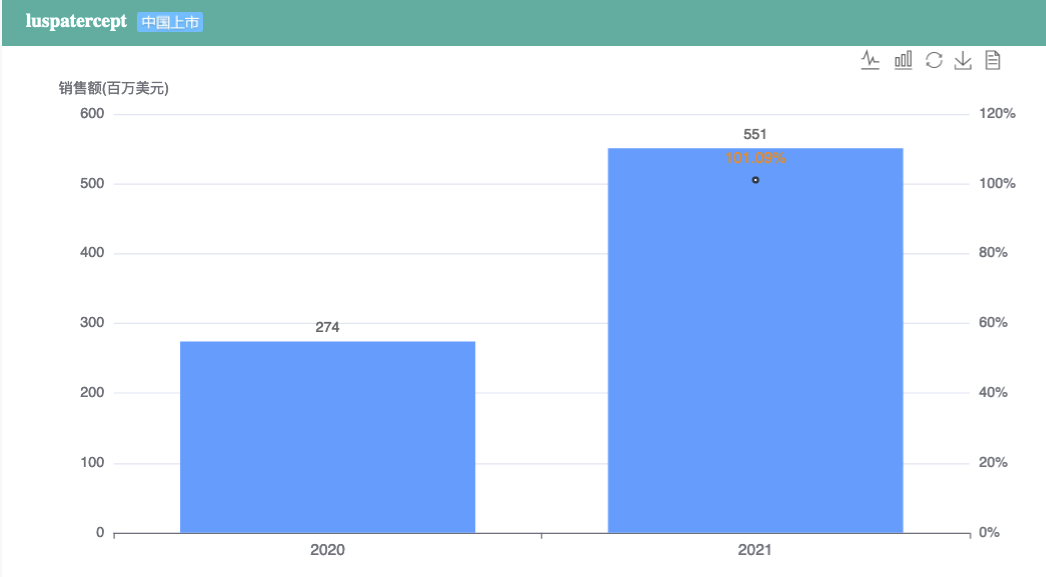
罗特西普最早由Celgene与Acceleron联合开发,后被百时美施贵宝(BMS)收购。相关专利:WO-2008097541。该药是一种人工合成的可溶性融合蛋白,由人免疫球蛋白G1(IgG1)的Fc结构域与活化素受体IIB(ActRIIB)的细胞外结构域融合而成。目前是美国FDA批准的唯一一个红细胞成熟剂(EMA)。2021年,本品全球业绩为5.51亿美元,同比增长101%。
罗特西普全球销售情况
截图来源:药融云全球销售数据库
罗特西普作用于红细胞成熟的晚期阶段,通过与调控红细胞成熟的关键因子—特定TGF-β超家族配体结合,降低异常增强的Smad 2/3信号通路的转导,从而恢复晚期红细胞成熟,使机体能够产生更多正常红细胞。
罗特西普每三周皮下注射一次,即可有效降低贫血、铁过载及输血并发症的发生率,显著减少患者就诊、输血、祛铁的时间与频次。该适应症是基于境外数据附条件批准上市,本品治疗中国患者的有效性和安全性尚待上市后进一步确证。
此次罗特西普在中国获批是基于一项随机、双盲、安慰剂对照、多中心的Ⅲ期临床研究BELIEVE。研究的主要终点结果显示,治疗第13至24周时,罗特西普组有21.4%的患者输血负担较基线下降≥33%(且至少下降2个红细胞单位),近5倍于安慰剂组。此外,任意24周期间,罗特西普组输血负担降低33%的患者比例是安慰剂组的15倍(41.1%vs2.7%);治疗48周时,罗特西普组患者血清铁蛋白水平较基线平均下降248μg/L,而安慰剂组平均升高107μg/L。
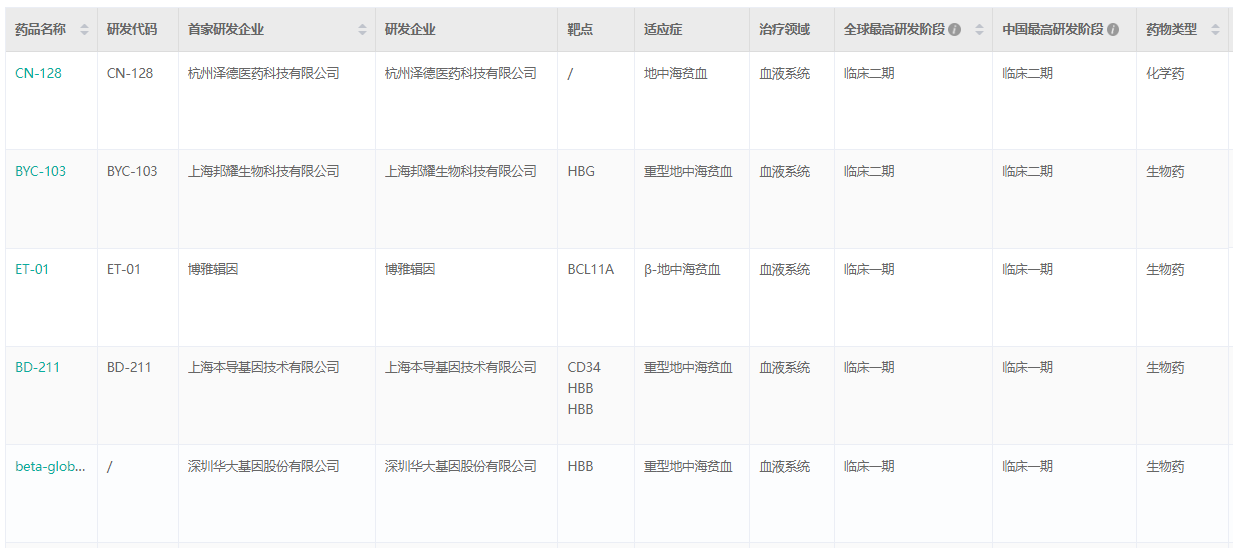
药融圈旗下,药融云数据显示,国内在开发不同类型地贫药物的有:邦耀生物、本导基因、瑞风生物、ASC Theraputics、博雅辑因、康霖生物的基因治疗产品;泽德医药的新药CN-128 以及地拉罗司仿制药等。
国内部分地贫在研药物(临床一期及以上)
截图来源:药融云全球药物研发数据库
分享:
我国药审中心CDE公布了注射用罗特西普申请上市技术审评报告审评报告。发送
罗特西普(请正确复制)至
药融圈微信公众号(扫描下二维码)后台可获得原文件。仅供学习交流分享!
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据:https://www.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
Cappellini MD, Viprakasit V, Taher AT, et al. A Phase 3 Trial of Luspatercept in Patients with Transfusion-Dependent β-Thalassemia[J]. N Engl J Med, 2020, 382(13): 1219-1231;
国际地贫联盟(TIF);
https://ashpublications.org/blood/article/136/Supplement%201/52/470084/Favorable-Outcomes-in-Pediatric-Patients-in-the;
百余家中国药企,布局基因治疗领域;等等。
想要解锁更多药企药物信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、申报情况、审批情况、最新进展、市场竞争格局、销售情况、市场规模与前景,可否投入仿制与研发!注册立享15天免费试用和虎年首份医药数据大礼包! <END>

















收藏
登录后参与评论