一、1.2亿美元,Argenx从蓝鸟生物手中购入优先审评券
荷兰生物制药公司
Argenx近期宣布与
Bluebird Bio/蓝鸟生物达成协议,
将以1.02亿美元收购其拥有的美国FDA罕见儿科疾病优先审评券(Rare Pediatric Disease Priority Review Voucher,PRV)。这张优先审评券预计将
用于全球首款FcRn单抗重磅新药Efgartigimod未来新适应症的BLA。
优先审评券的监管快速通道可以应用于新药上市申请(NDA/BLA),可将美国FDA从标准的10个月审评时间缩短到6个月。
Bluebird Bio将利交易所得资金进一步开发公司的两种基因疗法Zynteglo®️(betibeglogeneauto temcel,beti-cel) 和 Skysona®️( elivaldogeneauto temcel,eli-cel),新的现金流支持公司运营。Bluebird Bio曾经是细胞基因治疗独角兽与先驱,前沿的高壁垒领域。因一系列的延迟、临床挫折和商业竞争,Bluebird Bio在过去几年最多时候失去了超过90%的市值,目前约6.64亿美元市值。
二、全球首款FcRn单抗重磅新药
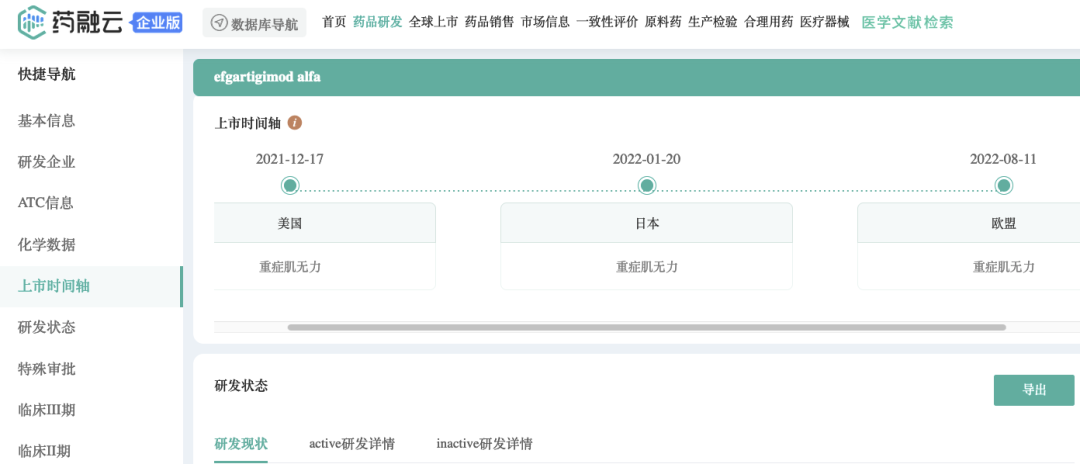
药融云数据,vip.pharnexcloud.com/?zmt-mhwz显示:2021年12月17日,美国FDA批准
Vyvgart(Efgartigimod alfa-fcab)用于治疗抗乙酰胆碱受体(AChR)抗体阳性的成人
全身型重症肌无力(gMG)。
▲截图来源:药融云全球药物研发数据库
全身型重症肌无力(gMG)是一种罕见的慢性自身免疫性神经肌肉疾病,超过85%的肌无力(MG)患者在发病24个月内会进展为全身型重症肌无力(gMG),可能影响全身肌肉,导致极度疲劳和面部表情、言语、吞咽和活动困难。在更危及生命的情况下,可能因为呼吸衰竭、肺部感染等导致死亡。目前,确认携带有乙酰胆碱受体(AChR)抗体的患者约占gMG总人群的85%。
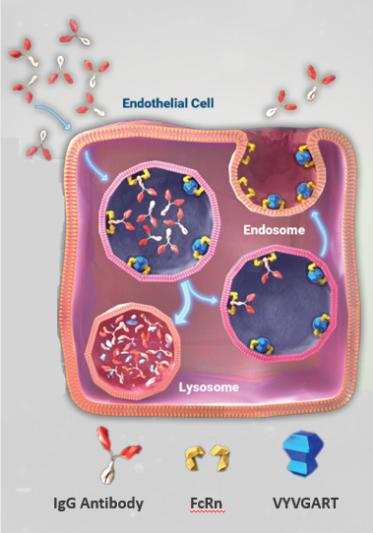
▲Efgartigimod阻断FcRn-IgG相互结合并将IgG从循环中去除;argenx
已获批的Efgartigimod(原研发代号ARGX-113)就源于公司与德克萨斯大学西南医学中心(UTSW)和Sally Ward教授的合作,后来成为了IIP(免疫学创新计划)的蓝图之一。Ward教授的研究在2013年确定了FcRn在IgG水平的维持和全身分布方面所起的关键作用。(事实上在1990年至2015年间,Ward教授一直领导研究了FcRn在调节IgG抗体水平和持久性方面的作用。2005年,她的团队描述了一种通过抑制FcRn活性来降低抗体水平的方法,并随后展示了该方法治疗抗体介导的自身免疫性疾病的临床前概念验证。)argenx从UTSW获得了与Efgartigimod相关的全球独家专利授权。
在国内,再鼎医药拥有Efgartigimod开发和商业化的独家许可权益。2021年1月,再鼎医药与argenx达成独家授权合作,再鼎医药将负责推进Efgartigimod在大中华区(包括中国内地、香港、台湾和澳门地区)的开发和商业化工作。根据协议条款,argenx将获得总计1.75亿美元的合作付款,其中包括7500万美元的预付款,以每股132美元的价格发行的568182股再鼎医药增发股票形式支付,7500万美元临床开发成本共担付款,以及Efgartigimod在美国获批后的2500万美元的里程碑付款。argenx同时将按比例获得Efgartigimod在大中华区的年净销售额分成。
再鼎医药与argenx交易信息
截图来源:药融云全球医药交易数据库
据药融云数据库查询显示,本品在中国已经递交了新药上市申请,2022年7月14日被CDE承办,目前已进入新报任务,排队待审评。
Efgartigimod审评时间轴
截图来源:药融云中国药品审评数据库
03.优先审评券超过一半被售出,最高卖到3.5亿美元
自美国2009年推出优先审评券以来的10年中,超过一半被出售。交易金额从6700万美元到3.5亿美元不等(2015年8月AbbVie以3.5亿美元的最高价购买了United Therapeutics公司的一张PRV)。在2009年至2019年被授予的31张优先审评券中,有16张已使用在新药上市申请中。此前在2022年7月14日,丹麦医药巨头诺和诺德(Novo Nordisk)与美股Marinus Pharmaceuticals(代码:MRNS )达成了一项交易,同意支付1.1亿美元以获得加快美国FDA审批的优先审评券。
热带疾病新治疗药物/罕见儿科疾病新治疗药物可能被授予优先审评券。PRV拥有者可以兑现审评券用于不符合其它较短监管审评时限的未来产品的优先审评,或者转让或出售其它公司兑现。更多
优先审评券相关政策,请复制以下链接阅读:
1.Guidance for Industry: Rare Pediatric Disease Priority Review Vouchers, Guidance for Industry,
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/rare-pediatric-disease-priority-review-vouchers。
2.Guidance for Industry: Tropical DiseasePriority Review Vouchers,
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/tropical-disease-priority-review-vouchers。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据,vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
Argenx purchases $100M+ FDA priority review voucher from bluebird bio;
海外观察:深耕抗体工程的argenx,造就全球首款FcRn单抗;
BehinA, Le Panse R. New Pathways and Therapeutic Targets in AutoimmuneMyasthenia Gravis. J Neuromuscul Dis. 2018;5(3):265-277. doi:10.3233/JND-170294. PMID: 30010142; PMCID: PMC6087460.;
Heo,Young-A. “Efgartigimod: First Approval.” Drugs vol. 82,3 (2022):341-348. doi:10.1007/s40265-022-01678-3.;
https://investor.bluebirdbio.com/news-releases/news-release-details/bluebird-bio-reports-fourth-quarter-and-full-year-2021-financial;
https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-myasthenia-gravis;
https://www.utsouthwestern.edu/newsroom/articles/year-2022/first-in-kind-drug.html;
等等。
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
<END>














收藏
登录后参与评论