分类依据:BCS是根据药物在水中的溶解度和肠壁渗透能力对药物进行科学分类的标准。
原料药按照BCS分为四类:
(1)BCS I类:高溶解性-高渗透性;
(2)BCS II类:低溶解性-高渗透性;
(3)BCS III类:高溶解性-低渗透性;
(4)BCS IV类:低溶解性-低渗透性。
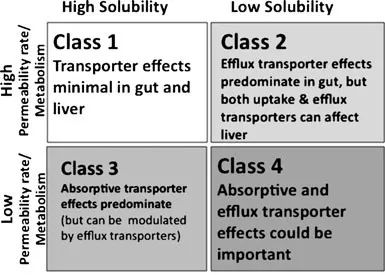
应用BCS对药物进行分类时,药物的剂量值、溶解度和渗透性必须已知。为了规范标准,WHO对剂量、溶解度和渗透性进行了定义和评价:
(1)剂量值:在BCS中,剂量除以溶解度的比得到的剂量值是WHO推荐的最大剂量(以mg计)。这个剂量值可能和一些国家处方规范信息中推荐的剂量不同,也可能与制药厂商提供的剂量不符。
(2)溶解性:高溶解性的药物是指在37℃下,PH在1-7.5的范围内,剂量/溶解度比值(D: Sratio)小于250ml的药物。将剂量(mg)除以溶解度(mg/ml)得到的比值(以体积ml为单位)与FDA的标准250ml相比,即可判断药物溶解度的高低。(3)渗透性:高渗透性药物是指在没有证据说明药物在胃肠道不稳定的情况下,有90%以上的药物被吸收药物(指相对于给药剂量的药物被吸收部分,而不是指整个人体系统的生物利用度)。
FDA推荐使用的有人体药代动力学数据、人体肠道灌肠流试验、原位动物模型数据或有效的单层细胞培养(通常是Caco-2细胞)数据。BCS理论对药物的剂型设计有重要的指导意义,在对不同类型药物进行制剂研究时,可根据BCS理论,合理设计剂型或制剂,有针对性的解决影响药物吸收的关键问题,有效地提高其生物利用度。

表 BCS在剂型设计中的应用
BCS不仅对药物的剂型设计有关键指导意义,还对生物等效性豁免试验提供了重要依据。自1995年Amidon提出BCS之后,1999年FDA拟定了第一个豁免草案,2006年WHO发布BE豁免指南,2016年CFDA发布人体生物等效性试验豁免指导原则。2017年12月,FDA发布了《依据生物药剂学分类系统豁免速释固体口服制剂体内生物利用度和生物等效性研究指导原则》,该指导原则指出原料药属于BCS I类(且制剂是速溶的)和III类(且制剂是极速溶的)的速释(IR)固体口服制剂的生物利用度(BA)或生物等效性(BE)研究可获得豁免。
2016年CFDA发布人体生物等效性试验豁免指导原则中指出,当口服固体常释制剂在体内的溶出相对于胃排空时间快或非常快,并且具有很高的溶解度时,药物的吸收速率和吸收程度就不会依赖于药物的溶出时间或在胃肠道的通过时间。因此,在这种情况下,对于BCS分类I类和III类的药物,只要处方中的其他辅料成分不显著影响API的吸收,则不必证明该药物在体内生物利用度和生物等效的可能性,即生物等效性豁免。
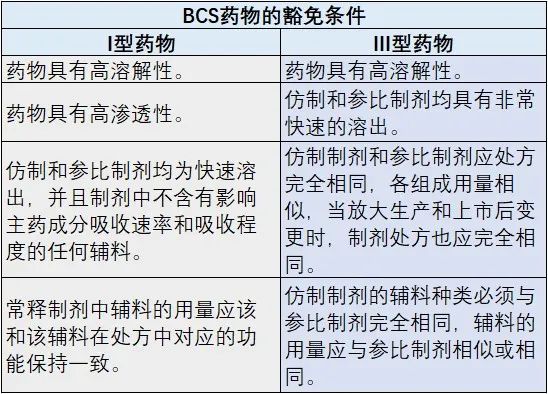
表 BCS类药物的人体生物等效性试验豁免条件
BCS和基于BCS的生物等效性豁免的概念,经过十多年的发展,已经陆续得到美国,WHO和欧盟等的监管机构的认可,该理论可以节约药品的研发成本和时间,成为新药研究和开发中强有力的工具之一,在保证药品质量的同时加快患者药品的可获得性。
参考资料https://wenku.baidu.com/view/f94bf858915f804d2b16c1ff.html
https://wenku.baidu.com/view/e35e6ce17cd184254a35353d.html?fr=search
<END>












收藏
登录后参与评论