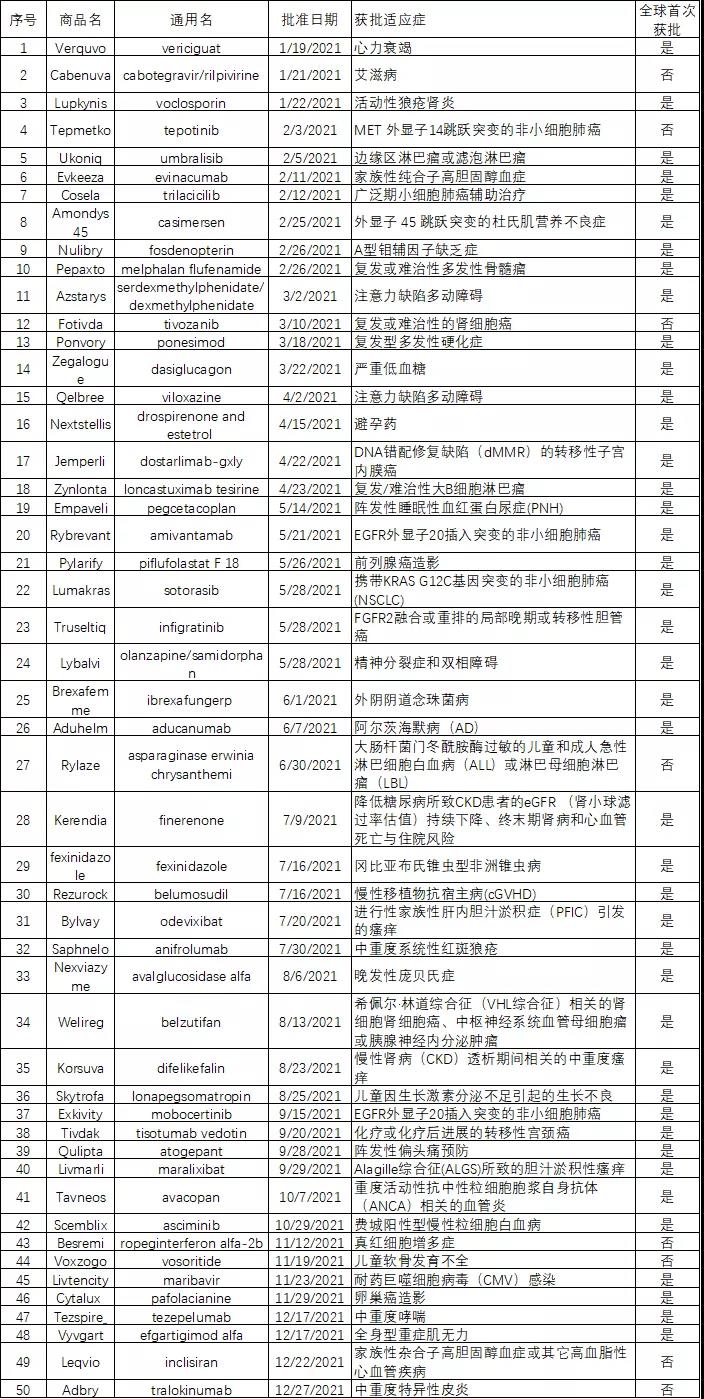
2020年FDA共计批准了50个新药,其中有42个为全球首次批准。按类型区分,50款新药中有14个为生物药,34个为小分子化药,2个为RNA。就治疗领域而言,罕见病,癌症依然是热点。
2021年FDA批准的50个新药
Leqvio(inclisiran)
12月22日,FDA批准了诺华的PCSK9抑制剂,该产品已经在2020年获得了EMA的批准,用于治疗成人高胆固醇血症或混合性血脂异常。
Inclisiran基本信息
截图来源:药融云全球药物研发数据库
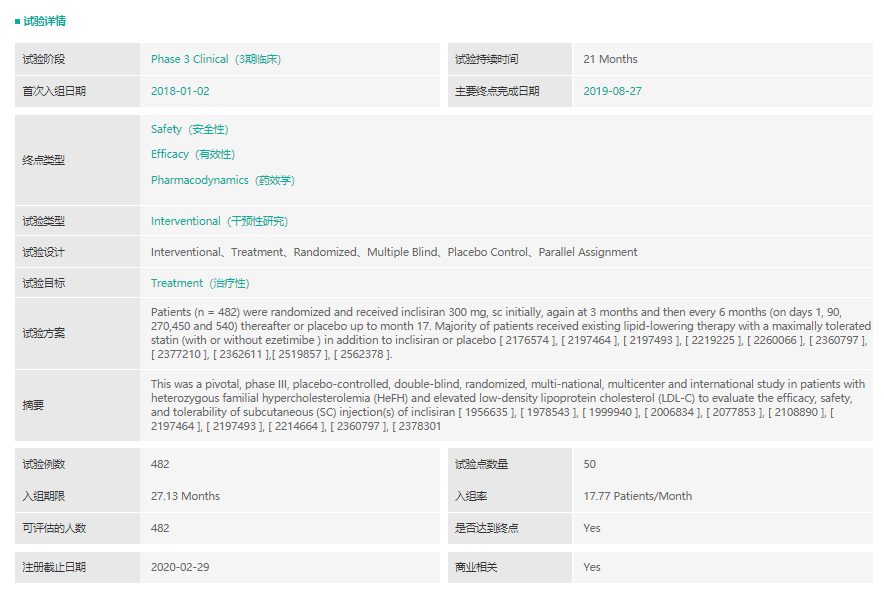
Inclisiran是一种小干扰RNA药物,可抑制肝细胞PCSK9的合成。EMA批准该产品是基于一系列名为“ORION”的临床研究项目,在该临床研究项目中,本品在他汀类最大耐受剂量的基础上,低密度脂蛋白(LDL-C)进一步下降52%。ORION-9(NCT03397121)是一项安慰剂对照、随机、双盲的三期临床研究,旨在评估inclisiran的安全有效性。482名杂合子家族性高胆固醇血症(HeFH)和低密度脂蛋白胆固醇(LDL-C)升高的患者参与了该项临床试验,按1:1随机分组,并在常规降脂药(他丁类、依折麦布)最大耐受剂量的背景治疗下使用本品或安慰剂治疗。患者在第一个月皮下注射300毫克(相当于284毫克)的inclisiran后的第3个月再次用药,随后每6个月用药一次。510天后统计结果显示,inclisiran治疗组LDL-C水平相比基线下降了39.7%,而安慰剂治疗组上升了8.2%,达到了统计学显著性差异,两组间不良反应发生率和严重程度相似。本品是诺华从MDCO公司天价买来的SiRNA,是预计销售额峰值可达40亿美元的重磅产品。
inclisiran实验信息
截图来源:药融云全球临床试验数据库
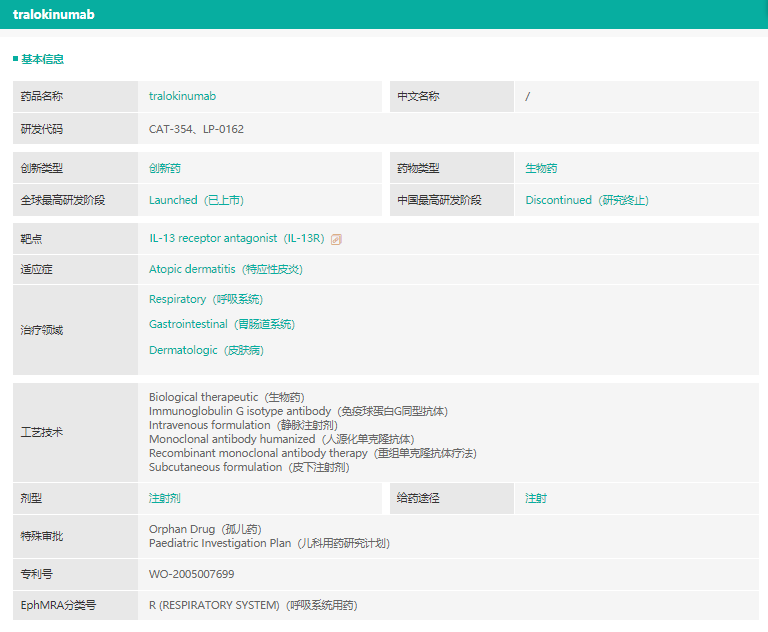
Adbry(tralokinumab)
12月27日,FDA批准了2021年的第50款新药tralokinumab,这是一款由LEO pharma开发的IL-13抑制剂,用于中重度特异性皮炎治疗。
tralokinumab基本信息
截图来源:药融云全球药物研发数据库
在此之前,本品已经在6月份获得了EMA的批准。截止发文之日,FDA的说明书还不可用,EMA说明书显示,两项分别有802和794名患者参与的临床试验证明了本品的疗效。两项试验均为3:1分组,分别给予本品或安慰剂,主要终点为16周研究者评分(IGA)为0分和1分及湿疹面积及严重度指数( EASI)相比基线改善达到75%的患者比例(应答率)。结果显示,两项试验的IGA评分应答率分别为15.8% vs 7.1%和22.2% vs 10.9%,EASI-75的应答率分别为25.0% vs 12.7%和33.2% vs 11.4%,均达到了主要终点,具体数据如下所示:
其余的48个产品,笔者已经在此前的文章中进行了一一解读,本文在此不做赘述。从近几年FDA批准的新药来看,普药越来越少,罕见病用药越来越多,小分子普药更是凤毛麟角,小分子仿制药的机会将越来越少,这也是国际仿制药巨头市值整体下滑的主要原因之一,另外随着集采的不断深入,仿制药立项会变得更加困难,如果领导们还在沉浸于“大品种”的思维,仿制药立项的小伙伴们,你们想好下一步该干什么了吗?
2020年FDA批准的产品解读请点击如下链接:













收藏
登录后参与评论