英雄不问出处;发展才是硬道理。
关于Horizon Therapeutics
Horizon Therapeutics(NASDAQ:HZNP)是一家处于商业开发阶段的生物技术公司,专注于开发治疗罕见疾病、自身免疫性疾病以及严重炎症性疾病的药物,以满足这些疾病领域的迫切需求。Horizon的研发目标是运用科学的专业知识,为患者带来具有临床意义的疗法,并改变生活。
Horizon创立于2008年,当时公司名字还是Horizon Pharma。
Horizon Pharma登陆纳斯达克。
Horizon Pharma以6.6亿美元收购爱尔兰专科药企Vidara Therapeutics International,并将全球总部迁往爱尔兰都柏林;
以4500万美元收购Nuvo Research公司在美国的骨关节炎药物Pennsaid(双氯芬酸钠)的经销权;
以11亿美元收购Hyperion Therapeutics,扩充孤儿药投资组合;
宣布以5.1亿美元收购Crealta Holdings;
以8亿美元收购罕见重症药物研发企业Raptor Pharmaceutical,将Procysbi(半胱胺重酒石酸氢盐)、Quinsair(左氧氟沙星)纳入其罕见病药物组合;
公司宣布将以1.45亿美元收购River Vision Development Corp,获得该公司在研眼科产品Teprotumumab,该产品于2020年1月获批上市,商品名Tepezza,成为全球首个也是目前唯一一款获批的甲状腺眼病(TED)治疗药物。
公司股东批准将公司名称更改为Horizon Therapeutics。
公司宣布以30.5亿美元收购生物技术公司Viela Bio,囊获自身免疫性疾病药物管线。该公司前身来自阿斯利康生物制品研发子公司MedImmune,并于2018年独立。
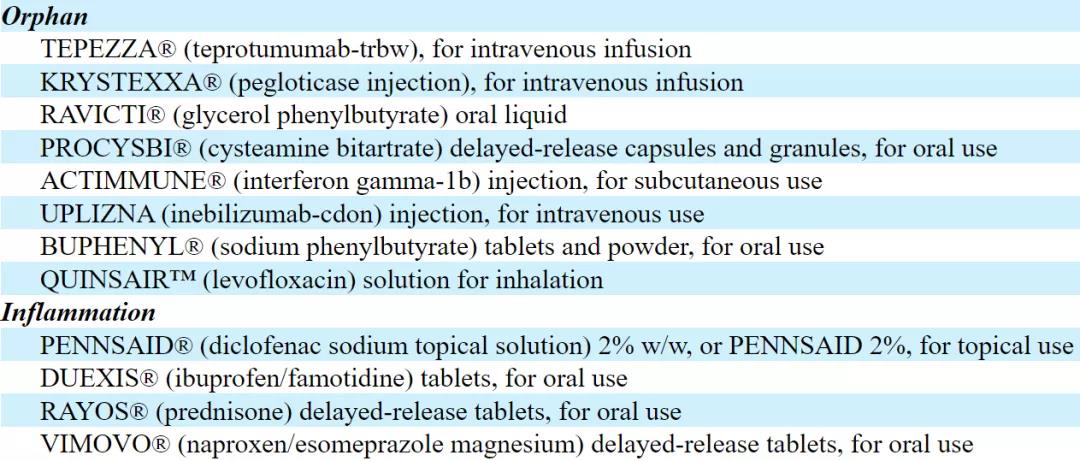
已上市产品包含多款First and Only
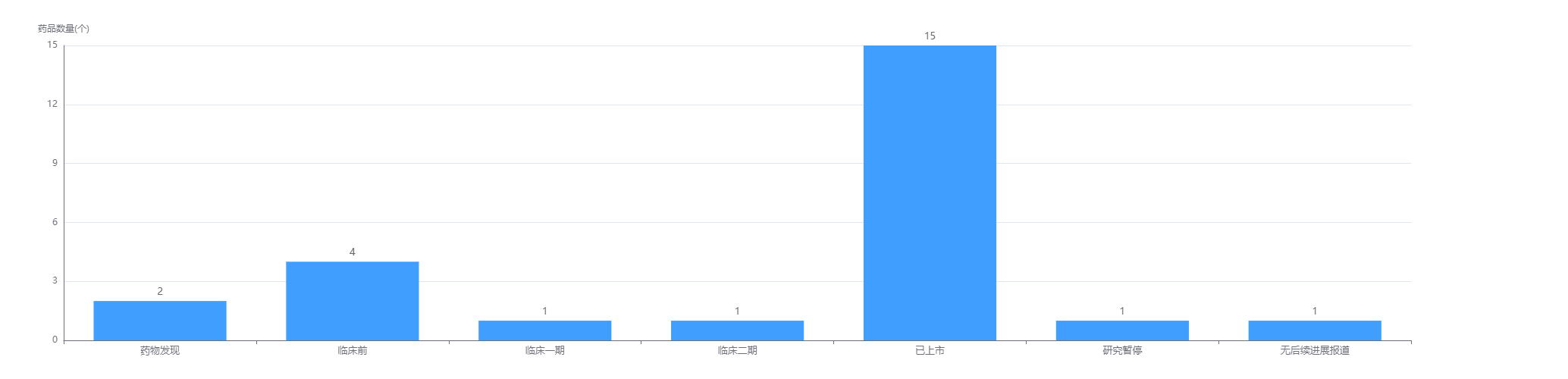
据药融云数据库显示,目前Horizon Therapeutics已有15款药物已上市,1款处于临床2期,一个处于临床1期阶段。
Horizon Therapeutics药物研发阶段
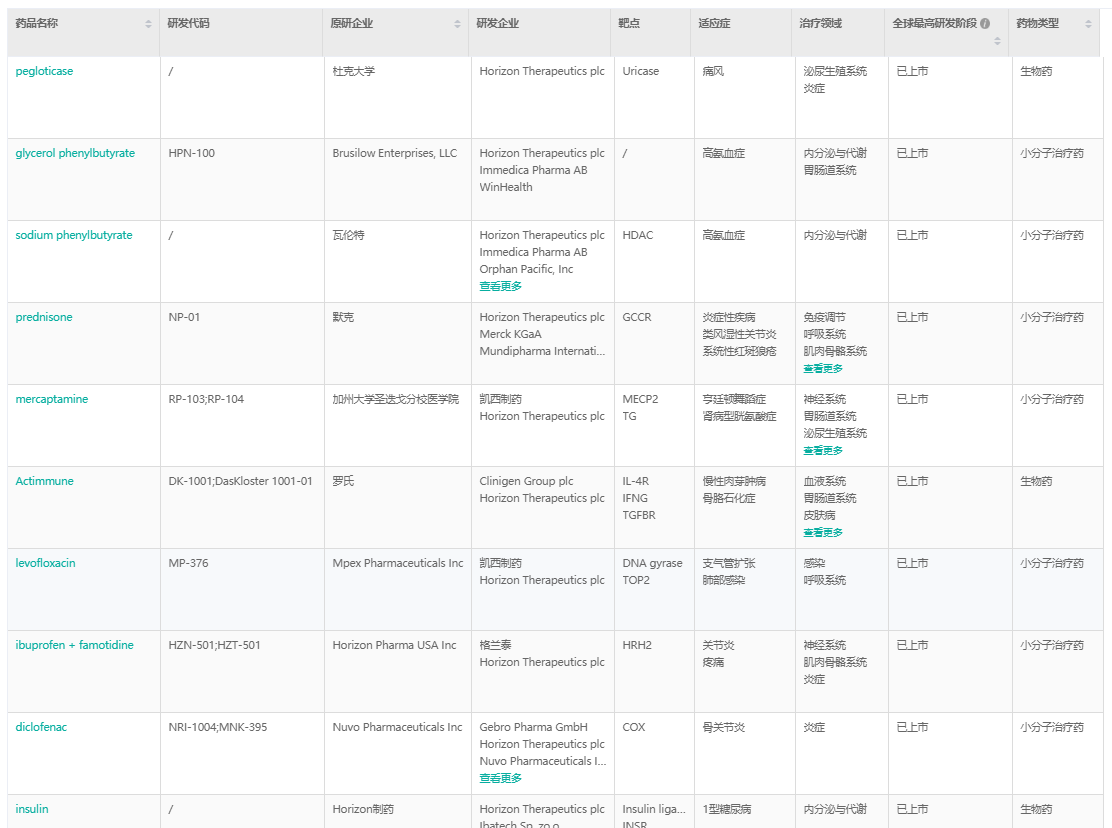
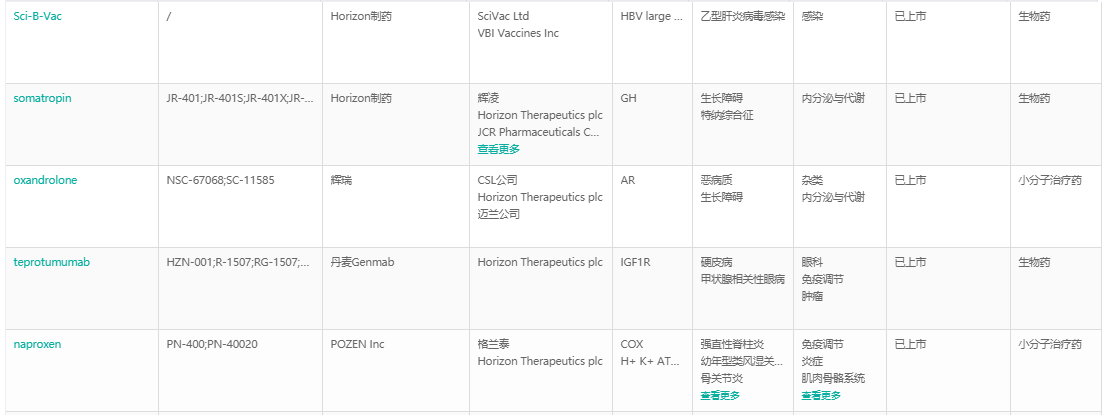
Horizon Therapeutics已上市药物
截图来源:药融云全球药物研发数据库
目前,Horizon总部位于爱尔兰都柏林,在欧洲、加拿大、美国和日本都设有分公司。公司的业务分为孤儿药部门和炎症药物部门。截至2021年9月30日,该公司药物投资组合包含12种药品,涵盖罕见病、痛风、眼科疾病、炎症疾病领域,具体如下图。
▲图源:Horizon Therapeutics财报
孤儿药
Tepezza(teprotumumab-trbw)是一款靶向
胰岛素样生长因子-1受体(IGF-1R)的抗体,最初由丹麦生物制药公司
Genmab于2005年开发,同年罗氏获得该药开发权益。IGF-1R曾是抗肿瘤药物的热门靶点,异常的IGF-1R信号传导与多种癌症相关。Teprotumumab最初被开发用于治疗实体瘤和血液瘤,包括乳腺癌、霍奇金淋巴瘤与非霍奇金淋巴瘤、非小细胞肺癌、肉瘤等。2009年,罗氏宣布放弃该产品肿瘤适应症的开发。2012年,罗氏拆分旗下业务部门,
River Vision Development Corp获得teprotumumab开发权益,用于眼科治疗,并获Horizon资助。2017年,
Horizon收购River Vision,继续开展teprotumumab的临床试验。2020年1月,Tepezza(teprotumumab)获批上市,用于治疗
甲状腺眼病(TED)。此前,FDA已授予该药治疗TED的
优先审查、突破性药物资格、孤儿药资格、快速通道资格。该药是全球首款也是目前唯一一款获批的TED治疗药物,仅2020年净销售额就达到
8.2亿美元,公司认为该药是
商业化最成功的罕见病药物之一,预计到2021年末,该产品总销售额将超过其前
期收购成本的16倍。甲状腺眼病(TED)是一种罕见、严重、进行性危机视力的自身免疫性疾病,会导致眼突出、复视、疼痛甚至毁容。多年来TED缺乏安全有效的的治疗药物,Tepezza(teprotumumab)疗效显著且安全性高,从源头上阻断IGF-1R通路,抑制信号复合物的产生,显著提高患者视觉功能和生活质量。Horizon预计该产品的全球年净销售额峰值将超过
35亿美元(U.S.>$3B, ex-U.S.>$500M),2021年预计将达到
16.25亿美元。

Krystexxa(中文名普瑞凯希,通用名pegloticase,聚乙二醇尿酸酶)是一款痛风药物,于2010年获FDA批准用于治疗常规治疗无效或常规治疗无法耐受的成人慢性痛风患者,也是
目前唯一一款无法控制的痛风(Uncontrolled Gout)治疗药物。痛风是最常见的关节炎类型,据估计,美国有950万名痛风患者,每年以低个位数百分比增长,其中传统疗法无法控制的痛风患者数量达到10万,并随着痛风患者数量增长而增长,Krystexxa(pegloticase)上市弥补了这一未满足的治疗市场需求。该药具有独特的作用机制,可迅速逆转疾病进展,与解决尿酸过度产生或排泄不足的传统XOI疗法不同,Krystexxa将尿酸转化为尿囊素,尿囊素是一种水溶性分子,可通过尿液轻松排出体外,其肾脏排泄效率是尿酸的10倍。该产品最先由美国生物制药公司
Savient Pharmaceuticals开发上市(其中,重组尿酸酶来自
杜克大学,聚乙二醇化[PEGylation]修饰技术来自
Mountain View Pharmaceu ticals [MVP]);2014年,Crealta Pharmaceuticals收购Savient;2016年,
Horizon完成对Crealta的收购,最终将该产品收入囊中。在2016年之前,该产品的商业潜力可以说是被低估了,后来通过Horizon公司强大的商业化执行能力与投资策略,改变了其增长轨迹,重新定义该领域市场潜力
。五年时间,Krystexxa净销售额翻了8倍(2015年:6千万美元,2021年预计:5.5亿美元),预计到2021年末,该产品
总销售额将超过其收购成本的3倍。
药融云数据www.pharnexcloud.com显示,目前该产品还没有直接的竞争对手。同时,最新临床研究数据显示,该药与其他免疫调节药物联用,效果显著优于单药,并且随着风湿病与肾病患者的数量增加,市场潜力将进一步扩大,公司预计Krystexxa(pegloticase)在美国的年净销售额峰值将超过
10亿美元,2021年预计将达到
5.5亿美元。

Uplizna(inebilizumab-cdon)是一款CD19单克隆抗体,于2020年6月获FDA批准用于治疗抗水通道蛋白-4(AQP4)抗体阳性的视神经脊髓炎谱系疾病(NMOSD)成人患者,是FDA批准的首款也是目前唯一一款治疗NMOSD的B细胞清除疗法。该产品最初由Cellective Therapeutic开发;2005年MedImmune收购Cellective;2018年Viela Bio从MedImmune独立,获得MedImmune的anti-CD19抗体资产;2021年Viela Bio被Horizon Therapeutics收购,Uplizna并入Horizon公司孤儿药产品组合。NMOSD是一种罕见的中枢神经系统自身免疫性疾病,攻击视神经和脊髓,也可影响大脑和脑干,会引起神经损伤的累积,可导致失明、瘫痪甚至死亡。在美国,大约有1万人被诊断为NMOSD,并且每年约有400例新诊断病例。约80%的NMOSD患者抗AQP4抗体检测呈阳性,该类抗体由B细胞分化的浆母细胞和浆细胞产生,其能结合广泛存在于中枢神经系统的星形胶质细胞,由此触发免疫反应,导致病变形成与星形胶质细胞死亡。CD19广泛表达于B细胞表面和其分化形成的浆母细胞/浆细胞表面,Uplizna(inebilizumab-cdon)特异性靶向并清除表达CD19的B细胞(包括浆母细胞和一些抗CD20疗法无法靶向的浆细胞), 从而减少抗原呈递。FDA曾授予该药治疗NMOSD的孤儿药称号和突破疗法认定。2019年5月,豪森药业与Viela Bio达成战略合作,以超过2.2亿美元的首付款+里程碑付款引进Inebilizumab在中国的开发和商业化权利,Inebilizumab主要在中国开发用于治疗视神经脊髓炎频谱障碍(NMOSD)和其他自身免疫疾病、血液恶性肿瘤。
Ravicti(glycerol phenylbutyrate,苯丁酸甘油酯)是一种氮结合剂,用于长期管理由
尿素循环障碍(UCD)引起的高血氨症。UCD是由构成尿素循环的酶或转运蛋白缺乏引起的罕见的遗传性代谢性疾病,会导致氨基酸分解代谢产生的氨不能通过尿素循环形成尿素排出体外,从而引起血氨水平升高,由于氨对神经系统有很强的毒性,这会导致不可逆转的脑损伤、昏迷或死亡。Ravicti(glycerol phenylbutyrate)必须配合低蛋白饮食,在某些情况下还需要膳食补充剂。
Procysbi(半胱胺重酒石酸氢盐)是一款治疗肾病性胱胺酸病(NC)的药物,该病是一种罕见的溶酶体贮积障碍,会导致胱氨酸积聚于几乎所有细胞的溶酶体内,形成晶体,从而引起全身组织和器官的细胞损伤和死亡,患者需要终身服药。Procysbi(半胱胺重酒石酸氢盐)原先由Raptor Pharmaceutical开发,2016年9月,Horizon收购Raptor。目前该药有缓释胶囊和缓释口服颗粒两种剂型,是FDA批准的首个也是目前唯一一款12个小时给药一次的治疗方案,而传统疗法则需要每6个小时给药一次,如迈兰公司开发的Cystagon®(半胱胺酒石酸胶囊)。
Actimmune(干扰素γ-1b)适用于治疗
慢性肉芽肿性疾病(CGD)、
重度恶性石骨症(SMO)。CGD是一种涉及吞噬细胞缺陷的原发性免疫缺陷病,患者的吞噬细胞无法产生过氧化氢、过氧化物和其他活性氧分子,因此细菌和真菌在被吞噬后无法被杀灭,患者更容易出现严重的细菌和真菌感染以及慢性炎症,可在肺、肝、淋巴结、消化道和泌尿系统出现反复脓肿;SMO是一种常染色体隐形遗传病,也被称为大理石骨病或婴儿恶性石骨症,患者在婴儿时期发病,进展快、病死率高、较少存活。Actimmune(干扰素γ-1b)是FDA批准的唯一一款可用于降低与CGD相关严重感染频率和严重程度,并延缓SMO患者疾病进展的药物。
Buphenyl(sodium phenylbutyrate,苯丁酸钠)适用于尿素循环障碍(UCD)患者的长期治疗,这类患者涉及氨基甲酰磷酸合成酶、鸟氨酸氨甲酰转移酶,或者精氨酸琥珀酸合成酶的缺乏。该药可用于新生儿患者(完全性酶缺乏,出生28天内发病),也可用于有高血氨性脑病家族史的迟发性患者(部分酶缺乏,出生一个月之后发病)。Buphenyl在北美和日本以外被称为Ammonaps,由Immedica公司进行销售。2020年10月,公司将Buphenyl在日本的开发与商业化权利也出售给Immedica,目前Horizon只保留该药在北美地区的权利。
Quinsair(levofloxacin,左氧氟沙星)是抗生素药物左氧氟沙星的一种剂型,通过喷雾器吸入,用于成年囊性纤维化(CF)患者的铜绿假单胞菌引起的慢性肺部感染。该产品原由美国制药公司Mpex Pharmaceuticals开发;2015年由Raptor Pharmaceutical从Mpex收购;2016年9月,Horizon以8亿美元收购Raptor,获其产品管线。Quinsair目前在加拿大和拉丁美洲进行销售,未在美国获批。
炎症药物
Pennsaid 2%(2%的双氯芬酸钠局部用溶液)用于治疗膝关节骨关节炎(OA)疼痛,是一种可直接局部施用于膝关节的止痛药,其中双氯芬酸钠是治疗OA疼痛的常用非甾体抗炎药(NSAID),并使用二甲基亚砜(DMSO)作为渗透剂,有助于确保双氯酚钠通过皮肤吸收到炎症和疼痛部位。Pennsaid 2%这类外用的非甾体抗炎药常被视为是比口服非甾体抗炎药更安全的替代疗法,可减少全身暴露。Pennsaid 2%也是唯一一款自带计量泵的局部非甾体抗炎药,可确保患者每次均可施用正确的剂量。
Duexis(布洛芬/法莫替丁片)适用于缓解类风湿性关节炎(RA)和关节炎(OA)的疾病体征和症状,并降低布洛芬治疗引起患者上消化道溃疡的风险。该药是由布洛芬和法莫替丁组成的复合片剂,可减少服用药丸的数量,确保患者服用正确的剂量,提高依从性。
Rayos(泼尼松缓释片)适用于治疗多种疾病:类风湿性关节炎(RA)、强直性脊柱炎(AS)、风湿性多肌痛(PMR)、原发性系统性淀粉样变、哮喘、慢性阻塞性肺病、系统性红斑狼疮(SLE)等。
Vimovo(萘普生/埃索美拉唑镁缓释片)适用于缓解关节炎(OA)、类风湿性关节炎(RA)和强直性脊柱炎(AS)的疾病体征和症状,并降低有发展非甾体抗炎药(NSAID)相关性胃溃疡风险的患者发展胃溃疡的风险。该药由速释的艾美拉唑镁层和肠溶衣的萘普生核心组成,萘普生是具有镇痛和抗炎性质的NSAID,而埃索美拉唑镁可减少可引起上消化道溃疡的胃酸分泌。
主要产品业绩
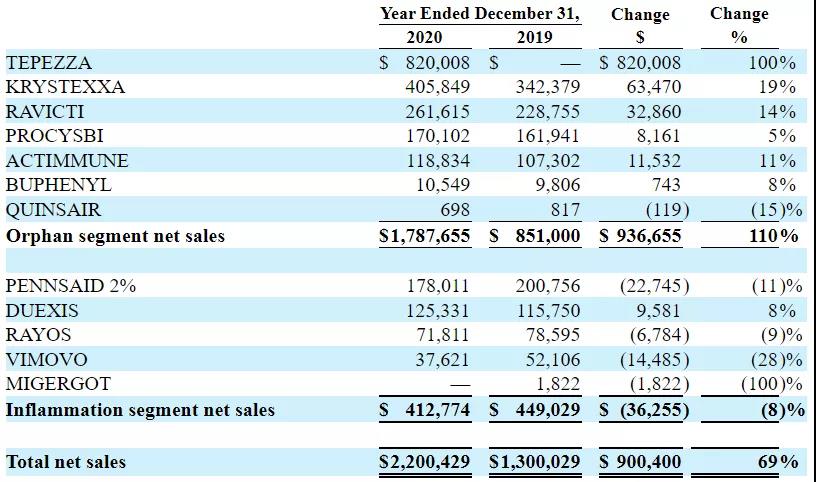
2021年2月24日,Horizon Therapeutics公布2020全年业绩,公司2020全年净销售额达到22亿美元(+69%),创历史记录,GAAP净收入为3.898亿美元,调整后EBITDA为9.987亿美元(+107%)。
其中孤儿药业务同比增长110%,达到17.88亿美元,主要受甲状腺眼病(TED)药物Tepezza(teprotumumab-trbw)推动,该药全年净销售额为8.2亿美元,大大超出预期。COVID-19大流行期间,尽管该药年度业绩强劲,但由于患者到访医生办公室和输液中心的意愿降低,其业绩仍受到一定程度的负面影响;Krystexxa(聚乙二醇尿酸酶注射液)净销售额达到4.059亿美元,同比增长19%;Ravicti(苯丁酸甘油酯)净销售额为2.616亿美元,同比增长14%;Procysbi(半胱胺重酒石酸氢盐)净销售额为1.701亿美元,同比增长5%;Actimmune(干扰素γ-1b)净销售额为1.188亿美元,同比增长11%;Buphenyl(苯丁酸钠)净销售额为1054.9万美元,同比增长8%;Quinsair(左氧氟沙星)净销售额为69.8万美元,同比减少15%。
炎症药物业绩为4.128亿美元,同比减少8%,主要是受到了COVID-19大流行的影响;其中,Pennsaid 2%(2%双氯芬酸钠溶液)全年净销售业绩为1.78亿美元,同比减少11%;Duexis(布洛芬/法莫替丁片)净销售业绩为1.253亿美元,同比增长8%;Rayos(泼尼松缓释片)净销售业绩为7181.1万美元,同比减少9%;Vimovo(萘普生/埃索美拉唑镁缓释片)净销售业绩为3762.1万美元,同比减少28%。
此外,公司主要在美国开展业务,2020年美国地区业绩为21.91亿美元,其他地区业绩为931.8万美元。
▲图源:Horizon Therapeutics财报
(单位:千美元,百分数除外)
2021年11月3日,Horizon Therapeutics公布2021财年前三季度业绩,公司2021财年前三季度净销售额达到22.12亿美元(+52%),GAAP净收入为3.613亿美元(+81%),调整后EBITDA为9.218亿美元(+47%)。
其中孤儿药业务同比增长69%,达到19.55亿美元;2021年前三季度,Tepezza(teprotumumab-trbw)净销售额为10.72亿美元,同比增长125%;Krystexxa(聚乙二醇尿酸酶注射液)净销售额达到3.95亿美元,同比增长43%;Ravicti(苯丁酸甘油酯)净销售额为2.176亿美元,同比增长14%;Procysbi(半胱胺重酒石酸氢盐)净销售额为1.425亿美元,同比增长16%;Actimmune(干扰素γ-1b)净销售额为8660.3万美元,同比增长4%;Buphenyl(苯丁酸钠)净销售额为579万美元,同比减少31%;Quinsair(左氧氟沙星)净销售额为73.3万美元,同比增长47%;2021年3月之后,Uplizna(inebilizumab-cdon)列入公司孤儿药产品组合,截至2021年9月30日,业绩为3502.5万美元。
2021年前三季度,炎症药物业绩为2.5689亿美元,同比减少13%;其中,Pennsaid 2%(2%双氯芬酸钠溶液)销售业绩为1.427亿美元,同比增长12%;Duexis(布洛芬/法莫替丁片)净销售业绩为6249万美元,同比减少28%;Rayos(泼尼松缓释片)净销售业绩为4355.1万美元,同比减少14%;Vimovo(萘普生/埃索美拉唑镁缓释片)净销售业绩为813.1万美元,同比减少74%。
▲图源:Horizon Therapeutics财报
(单位:千美元,百分数除外)
此外公司还更新了全年业绩指引,预计2021年全年净销售业绩将达到31.6亿美元至32.1亿美元,中位增长45%;Tepezza(teprotumumab-trbw)2021年全年净销售额将超过16.25亿美元;Krystexxa(聚乙二醇尿酸酶注射液)2021年全年净销售额将超过5.5亿美元;2021年全年调整后EBITDA预计在13.15亿美元至13.45亿美元之间,中位增长33%。
研发管线
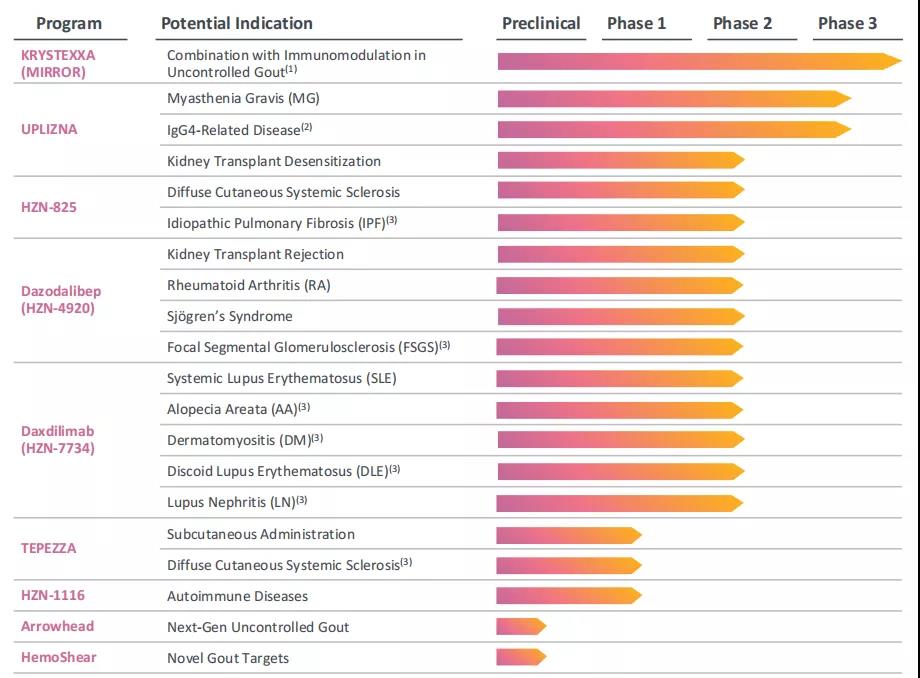
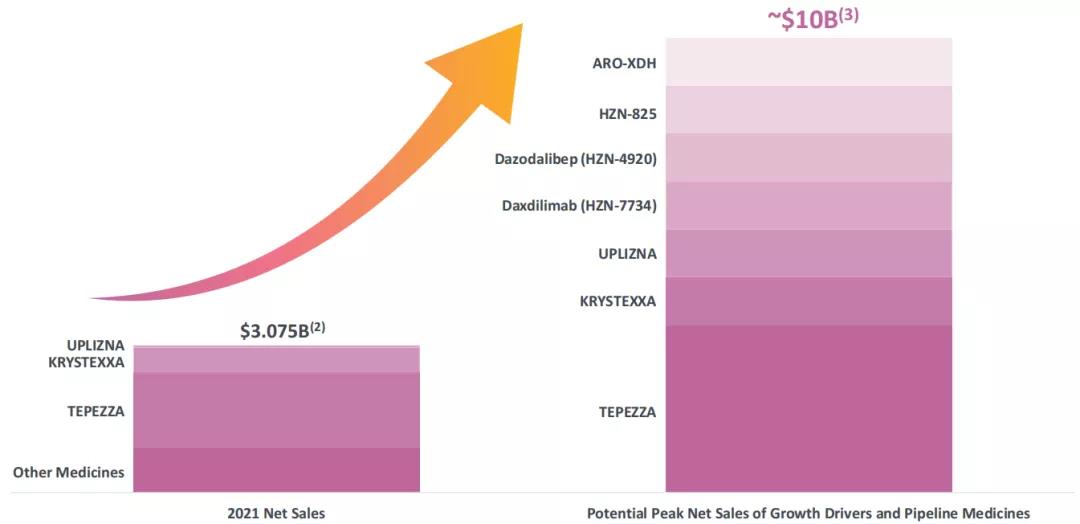
从新分子发现到已上市药品生命周期管理,Horizon Therapeutics正在为罕见疾病、自身免疫性疾病、严重炎症性疾病的患者探索潜在的新疗法,改善患者预后,并推动公司实现长期的增长。完成对Viela Bio的收购之后,公司大幅增加其研发管线的广度与深度,在研产品适应症涵盖慢性甲状腺眼病(TED)、痛风、IgG4相关性疾病、重症肌无力、肾移植脱敏、 弥漫型系统性硬皮病、特发性肺纤维化、局灶性节段性肾小球硬化、类风湿性关节炎、斑秃、皮肌炎、系统性红斑狼疮、狼疮性肾炎等。公司计划在2021至2023年进行10次临床试验数据readout。
▲Pipeline概览(更新至2021年11月3日)
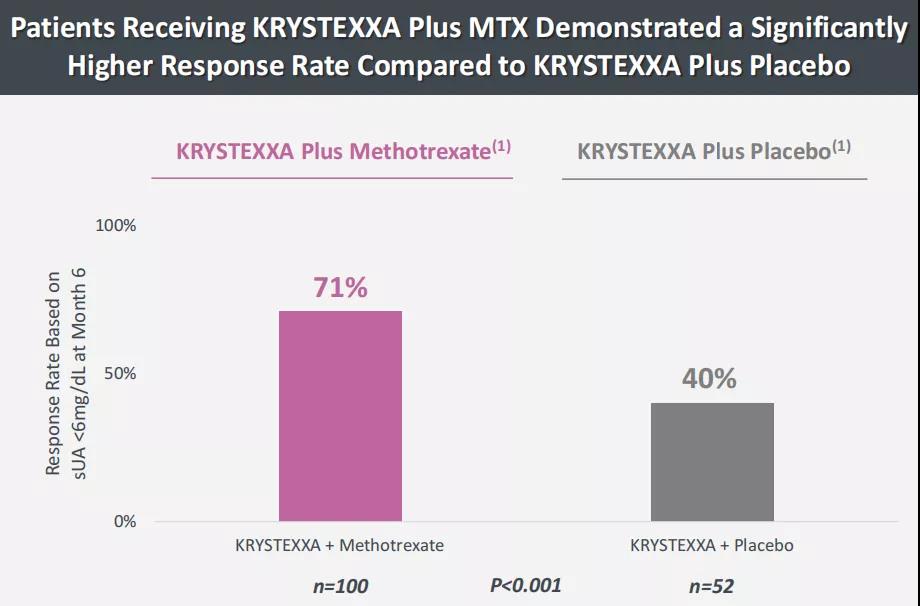
针对痛风药物Krystexxa(聚乙二醇尿酸酶注射液),公司开展了一项多中心、随机双盲、安慰剂对照的4期研究(MIRROR试验),旨在比较Krystexxa联合甲氨蝶呤(MTX)与Krystexxa单药治疗传统疗法无法控制的痛风(uncontrolled gout)的安全性、耐受性与药代动力学(NCT03994731)。MTX是一种免疫调节剂,为抗叶酸类抗代谢药,具有很强的免疫抑制作用。将Krystexxa与免疫调节剂联合使用是公司战略的核心要素,旨在最大限度的提高Krystexxa的价值,让更多传统疗法无法控制的痛风患者从药物中获益。2021年10月,公司披露了4期MIRROR随机、安慰剂对照(MIRROR RCT)试验的积极结果,在接受Krystexxa联合MTX治疗的患者中,71%的患者(100人中有71人)在第六个月达到完全缓解(CR),而接受Krystexxa单药治疗的患者中,40%的患者(52人中有21人)在第六个月达到CR。Horizon计划在2022年第一季度向FDA提交补充生物制剂许可申请(sBLA)。
此外,公司还完成了一项4期PROTECT试验(NCT04087720),该开放标签试验旨在评估Krystexxa在接受过肾移植的痛风患者中的安全性与疗效,结果显示有89%的患者达到主要终点;另一项开放标签4期研究(ADVANCE试验,NCT04772313)正在进行中,该试验旨在研究Krystexxa联合MTX治疗先前使用Krystexxa单药治疗失败的痛风患者的安全性与疗效;为了提高患者依从性,公司开展了一项4期开放标签研究(AGILE试验,NCT04511702),旨在评估缩短Krystexxa输液时间对患者耐受性的影响,当前输液时间需要2小时以上,而该试验将探索60分钟、45分钟和30分钟输液方案在MTX无法控制的痛风患者中的耐受性与安全性;4期FORWARD试验(NCT04762498)正在探索16mg每个月1次给药方案,而现有给药方案为8mg每月2次。
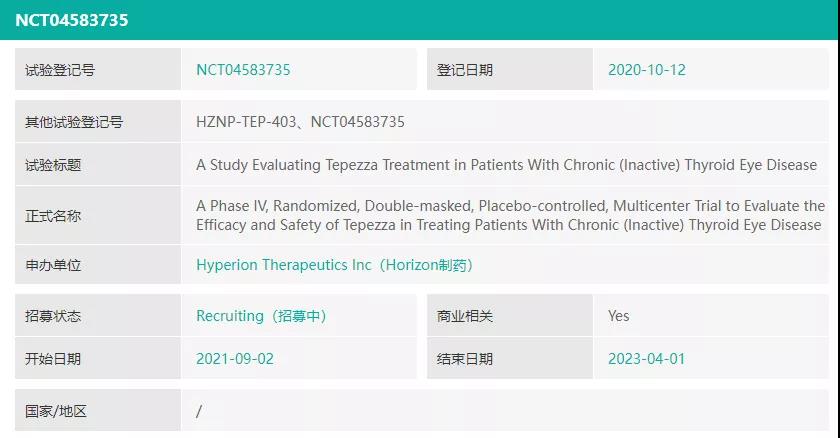
甲状腺眼病(TED)药物Tepezza(teprotumumab-trbw)正在开展一项多中心、随机双盲、安慰剂对照的4期临床试验(NCT04583735)。TED是一种严重的进行性罕见自身免疫性疾病,它始于急性期,显示出炎症体征和疾病症状,如眼痛、肿胀、眼球突出(眼部突出)和复视,并随着时间的推移而进展,急性期之后是慢性期,其中炎症不再存在或已显著减少,但显著的疾病体征和症状可能会继续影响患者生活质量。该试验的目的是研究Tepezza在慢性TED患者中的疗效、安全性和耐受性,试验结果预计将在2022年下半年披露。药融云数据www. pharnexcloud.com显示,该试验于2021年9月完成首例患者入组。
▲来源:药融圈旗下药融云数据库
此外,公司计划于2021年第四季度开启一项1期探索性试验,探讨Tepezza治疗弥漫性皮肤系统性硬化症患者的疗效;一项1期药代动力学试验正在进行中,探索Tepezza的皮下注射(SC)给药方案。
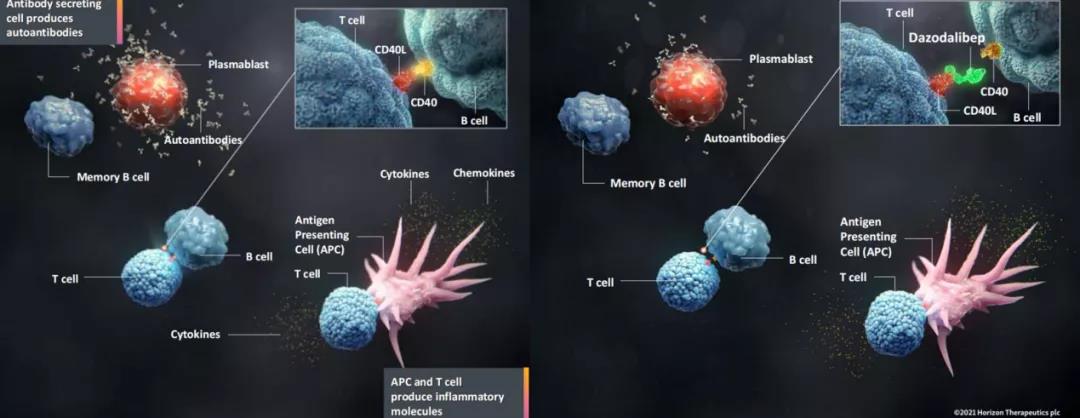
CD19单抗Uplizna(inebilizumab-cdon)正在积极拓展适应症,以发挥更大的潜力。一项多中心、开放标签的随机双盲、安慰剂对照的3期研究(NCT04524273)旨在评估inebilizumab在成人重症肌无力(MG)患者中的疗效与安全性,预计主要终点完成时间为2023年6月。MG是一种慢性、罕见的自身免疫性神经肌肉疾病,其症状包括骨骼肌无力,尤其是控制眼、口、喉和四肢的骨骼肌;一项多中心、随机双盲、安慰剂对照的3期研究旨在评估inebilizumab预防IgG4相关疾病(IgG4-RD)发作的有效性和安全性(NCT04540497),预计主要终点完成时间为2023年6月。IgG4-RD是一组慢性、进行性炎症伴纤维化的疾病,其特征是受累器官的肿瘤样肿胀和纤维化,如胰腺、唾液腺和肾脏;此外,公司还开展了一项前瞻性2期开放标签的随机试验(NCT04174677),以评估inebilizumab、在研的靶向CD40L的融合蛋白dazodalibep(研发代码HZN-4920,前称VIB-4920),以及两者联合用于高度致敏肾移植受者脱敏治疗的安全性和耐受性,预计主要终点完成时间为2021年12月。
Dazodalibep(研发代码HZN-4920,前称VIB-4920)是一款靶向T细胞表面CD40L的融合蛋白,可阻断其与表达CD40的B细胞的相互作用,从而切断涉及许多自身免疫性疾病与炎症性疾病的中枢通路。一项随机双盲、安慰剂对照的2期概念验证研究(NCT04129164)旨在评估dazodalibep在成年Sjögren综合征(SS,又称干燥综合征)患者中的疗效、安全性和耐受性。该病是一种以严重的眼、口腔和其他部位粘膜干燥为特征的慢性炎性疾病,严重者可累及多个器官。局灶性节段性肾小球硬化(FSGS)是一种攻击肾脏过滤单元(肾小球)的罕见疾病,会造成严重的瘢痕,导致永久性的肾脏损伤,甚至肾衰竭,公司预计将于2022年下半年开启dazodalibep针对FSGS的2期临床试验。此外,公司还开启了一项评估dazodalibep在类风湿性关节炎(RA)成年患者中的疗效、安全性和药代动力学的2期剂量爬坡试验(NCT04163991),以及一项2a期开放标签试验(NCT04046549)旨在评估dazodalibep联合免疫抑制剂belatacept治疗肾移植排斥反应的疗效、安全性和耐受性。
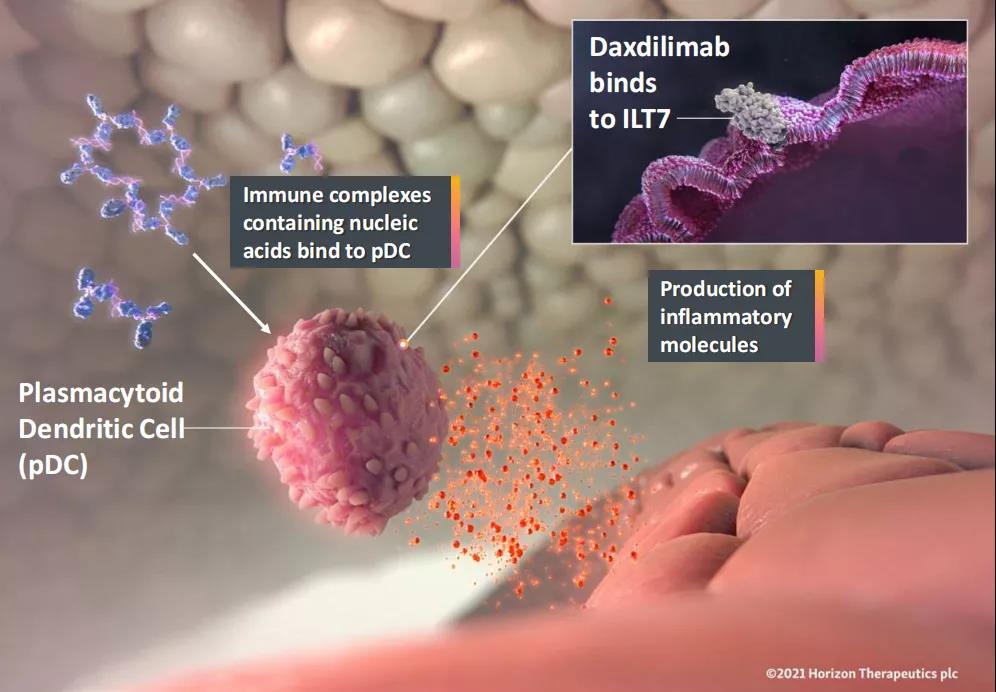
Daxdilimab(研发代码HZN-7734,前称VIB-7734)一种靶向ILT-7(免疫球蛋白样转录本-7)的全人源单克隆抗体,可清除特定的浆细胞样树突状细胞(pDC),中断炎症循环,从而潜在地治疗自身免疫性疾病,该药是全球首款也是目前唯一一款进入临床阶段的pDC清除剂。目前,该药正在开展一项随机双盲、安慰剂对照的2期研究(NCT04925934),旨在评估daxdilimab治疗中度至重度急性系统性红斑狼疮(SLE)的安全性与疗效,预计主要终点完成时间为2023年7月。此外,公司将于2022年上半年开启一项2期试验,用于评估daxdilimab在斑秃(AA)患者中的应用潜力;针对盘状红斑狼疮(DLE),公司将于2022年上半年开启一项2期临床试验;针对狼疮性肾炎(LN)以及皮肌炎(DM)的2期临床试验预计将分别于2022年下半年启动。
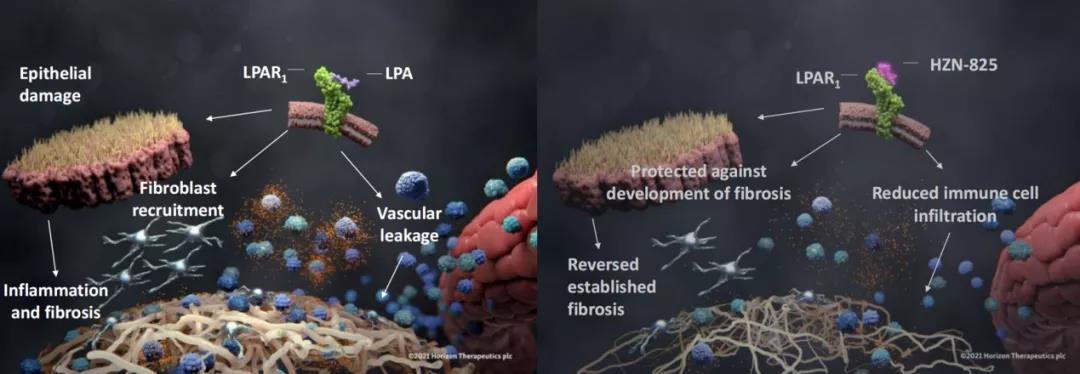
HZN-825是一款靶向LPAR1(溶血磷脂酸受体1)的口服小分子抑制剂,在纤维增生性疾病这一具有高度未满足需求的领域中显示出早期的获益信号。公司分别启动了该药治疗弥漫性皮肤系统性硬化症以及治疗特发性肺纤维化(IPF)的2b期关键试验(NCT04781543、NCT05032066)。
HZN-1116(前称VIB-1116)是一款单克隆抗体,被研究用于自身免疫性疾病。2021年7月,公司启动了一项随机双盲、安慰剂对照的1期临床研究(NCT04948099),旨在评估经典/常规树突状细胞(cDC)和浆细胞样树突状细胞(pDC)介导的风湿性疾病中单次递增剂量VIB-1116的安全性、药代动力学和药效,预计主要终点完成时间为2022年9月。
除此之外,公司还有两项license合作,值得注意的是,这两项合作引进的产品都是治疗痛风的潜在药物。以Krystexxa(聚乙二醇尿酸酶注射液)为入口,公司有志于成为痛风领域的领导者。
2019年1月,Horizon与临床阶段生物技术公司HemoShear Therapeutics达成独家合作协议,将HemoShear的REVEAL-Tx™平台和药物发现功能与Horizon的风湿病学开发和商业化专业知识相结合,共同开发治疗痛风的新药,根据协议HemoShear将有资格获得可能超过5亿美元的里程碑付款以及特许权使用费。目前,从HemoShear引进的产品还处于临床前开发阶段。
2021年6月,Horizon与美国生物技术公司Arrowhead Pharmaceuticals宣布达成全球合作与许可协议,共同开发靶向黄嘌呤脱氢酶(XDH)的RNAi药物ARO-XDH。(相关阅读:
RNAi先驱药企:Arrowhead数箭齐发,布局紧凑。)根据协议,Arrowhead将获得4千万美元的首付款(已在2021年7月完成),并有资格获得高达6.6亿美元的潜在研发、监管和商业化里程碑付款以及销售分成;Arrowhead负责临床前开发工作,Horizon负责临床研究与商业化。目前,该候选疗法处于临床前研究阶段。
结 语
Horizon Therapeutics在行业内被称为“BD典范”、“捡漏王”,其领头的几款产品最初都是从外部收购而得,尤其是Tepezza(teprotumumab-trbw)从罗氏的“肿瘤弃药”摇身一变成为“TED之光”,成为重磅炸弹级药物已经毫无悬念。作为一家领先的创新驱动型biotech,Horizon具有一流的商业化执行能力以及快速推进的研发管线,并实现了快速增长与转型。从2018年到2021年,其产品净销售额复合年均增长率预计达到37%,公司的研发投入也在逐年增长,在2021年完成对Viela Bio的收购之后,其研发管线实现大幅扩充。除了罕见病、自身免疫性疾病,公司在近几年开始重仓痛风领域,并有志于成为痛风领域的领导者。出色的商业化能力、BD能力以及研发实力,将为公司提供长期增长的动力。在2021年9月Horizon首届研发日活动上,公司表示,若一切进展顺利,未来将有7款产品有潜力成为重磅炸弹级药物。不过新药开发风险巨大,未来如何,Only time will tell.
参考资料:
NMPA/CDE;
药融云数据,www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露;
https://www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-thyroid-eye-disease;
https://www.fiercebiotech.com/biotech/fda-approves-krystexxa-tm-pegloticase-for-treatment-of-chronic-gout-adult-patients;
https://www.horizontherapeutics.com/medicines/portfolio;
https://www.horizontherapeutics.com/science/pipeline;
https://ir.horizontherapeutics.com/node/18581/html;
https://ir.horizontherapeutics.com/node/19676/html;
徐杰, 王茜. 局灶性节段性肾小球硬化[J]. 中国社区医师, 2003, 19(9):2.
https://hemoshear.com/news/horizon-pharma-plc-and-hemoshear-therapeutics-enter-into-exclusive-drug-discovery-collaboration-in-gout;
BD典范Horizon:Teprotumumab从罗氏肿瘤弃药到TED之光,上市首年销售额达到8亿美元丨凯莱英药闻;
7亿美元「捡漏王」Horizon拿下美国老牌药企RNAi疗法全球开发权益丨
生辉SciPhi;等等。
<END>




























收藏
登录后参与评论