创新药研发是一个从无到有,摸索前进的过程,因此创新药的研发具有渐进性和不确定性,主要包括处方前研究,处方工艺研究,IND申报,临床前研究,临床研究I、II&III期研究以及新药NDA申报,上市销售直至退市。在整个药品全生命周期中,药物面临着不断的变更。CDE这两年也发布了不少的变更指导原则,如药物临床试验期间方案变更技术指导原则(试行),已上市化学药品药学变更研究技术指导原则(试行)。
在2005年AAPS研讨会上,FDA的Ajaz Hussain指出,典型的药物产品开发周期将包括从FIH到商业制造的3-6次处方变更。这些变化的例子有:从胶囊转换为片剂,从湿法制粒转换为直接压片,改变生产地点,以及API多晶型的转变等。其中许多变更可能引发生物等效性(BE)研究。对于每项BE研究,程序上都会增加研究时间,并且存在失败的风险。即使两个处方是等效的,基于统计概率和个人间的可变性,总是存在失败的风险。BE研究失败是开发新药产品的主要障碍。将这种风险降至最低的最佳方法是在临床阶段之间不进行BE桥接研究。这可以通过将FIH处方商业化来实现,FIH处方成功地扩大了商业化规模。从国内的新药(metoo)研发策略上,新药在IND申报之时,即提供接近商业化处方工艺,可以避免一些不必要的变更,加快新药推进临床研究,尽快上市。
来源于参考文献1
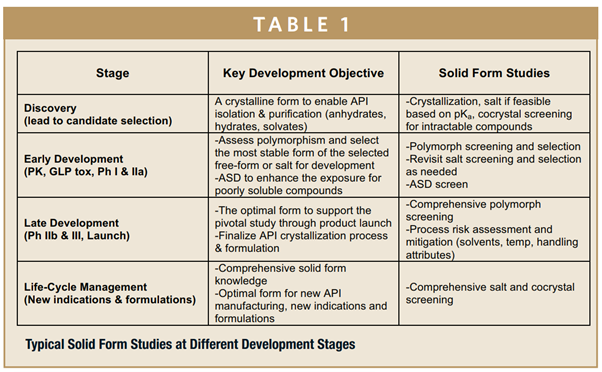
理想上是从一而终,现实仍然具有挑战,包括早期API的可及性,API开发工艺的不确定性以及API物理性质的不断转变性等。每个候选药物都是独一无二的,但是,其固态形式确实多种多样的,在药物开发过程中选择策略会有所不同。表1概述了在不同的开发阶段,如何进行API固态研究以实现特定的开发目标。在早期阶段,重点是确定合适的晶型以支持API的分离和纯化,并为临床前和临床研究提供具有足够溶解度和稳定性的原料药。随着开发的进展,在后期阶段会进行额外的研究,以评估和消除API和制剂生产过程中的固态形式风险,以增加对固态形式的了解,并通过为新适应症和处方选择最佳固态形式。下文我们谈谈固态形式转变的几种情形:
循序渐进固态形式转变
对于新药开发,首选热力学稳定型晶型作为优势晶型进行开发,以避免整个药物生命周期的变更。但是,实践开发过程中也要兼顾项目的进度以及不同研究阶段所要达到的目标,在早期开发不太可能进行全面的固态形式筛选,而且可能不同阶段可能采用迥异的固态形式。
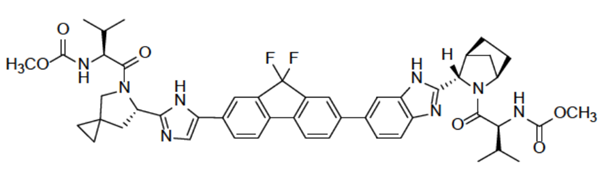
举例:Ledipasvir(GS5885)是一种HCVNS5Apolymerase抑制剂,用于治疗丙型肝炎病毒感染。吉利德的Harvoni于2014年10月10日获批上市,是固定剂量的sofosbuvir(索氟布韦)和蛋白酶NS5A抑制剂ledipasvir(雷迪帕韦)的复方组合。其中,雷迪帕维分子量为889.00,在3.0-7.5的pH范围内几乎不溶(<0.1mg/mL),并且在pH2.3以下(1.1mg/mL)微溶,属于BCSⅡ药物。
图1 Ledipasvir结构式 (来源于参考文献2)
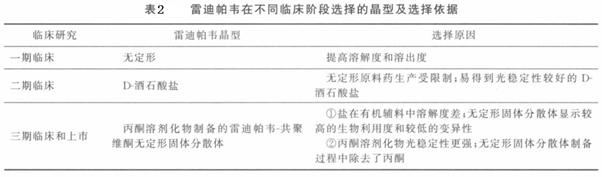
如表2所示,雷迪帕韦Ledipasvir在不同临床研究阶段所选择的晶型及依据。雷迪帕韦具有溶剂化物在内的18种晶型,上市产品为单丙酮溶剂化物晶型,因其API在制备出储存中具有良好的稳定性且在喷雾干燥制备固体分散体时可以清除丙酮,避免了溶剂残留。Ledipasvir:共聚维酮固体分散物(1:1)是通过在乙醇中溶解ledipasvir和共聚维酮,然后将混合物喷雾干燥而制成的。将sofosbuvir粉末混合物与ledipasvir粉末混合物压成双层片芯。具体筛选过程可以细细研究申请专利:两个抗病毒化合物的联用制剂以及国内仿制药研究过程如:复方雷迪帕韦/索氣布韦片的处方和制备工艺研究。
来源于参考文献3
雷迪帕韦并未查到单药申报的内容,其固态形式从首次人体试验直到申报临床,随着研究的深入,根据药物的理化性质特点(溶解性,稳定性及可生产性等因素)以及研究需要,不断的变化着固态形式,不断进行着BE的研究,最终产品也完成了上市。由于这种抗丙肝病毒“鸡尾酒”复方制剂是吉利德公司在研制索磷布韦后,推出的治疗慢性丙肝病毒感染的第二代产品,因此也被人们俗称为“吉二代”。
创新性药物研发过程中原料药固态形式变更的主要原因为:①可重复生产性难以为继。②长期放置过程中,稳定性不佳。③所制备的制剂质量不佳,如生物利用度问题。新药研发过程中,晶型变更主要在化合物进入到后和一旦顺利完成临床Ⅱ期。进入临床Ⅰ期后,一来评估临床Ⅰ期所用的晶型能否满足临床后期及上市后的需求,二来考虑专利布局。临床Ⅱ期完成后进行最后一次晶型筛选,不仅评估原有晶型的优劣,还尽可能地发现该化合物所有可能存在的晶型,并展开相应的专利保护。
主动固态形式转变
主动固态形式转变,实为药品生命周期的延长为目的。一种情况,某产品以一晶型进行上市申请,此种晶型带来了不好的生产体验,如粘冲,可是在后续的固态形式研究中,发现更为稳定的晶型或者改变/改善了API的不良的理化性质,且具有一定技术壁垒,不妨申报最新的晶型,以延长专利期。英国葛兰素公司研发的抗溃疡药雷尼替丁,晶 I 型专利过期后又发现晶 II 型,并以晶 II 型作为药用晶型,通过申请新晶 II 型的专利保护,有效延长了药物的专利效期,为制药企业带来丰厚利润。
还有一种情况,一开始选择晶体药物进行临床研究中,发现药物的体内生物利用度不足,进而转变至开发成无定形固态分散体,以提高药物的体内吸收,不至于因为活性分子较高的脂溶性而错失上市的机会。
被动固态形式转变
固态形式的不同可能会影响药物的理化性质,包括溶解度,溶出,生物利用度等。一个最不想发生的情况就是一个产品已经上市,然后固态形式发生了转变。一个比较知名的案例就是利托那韦。在文章“新药开发之实例跟踪晶型转变之一波三折”已经详细介绍了个中缘由,在此不再絮叨。
在制剂开发过程中,依然需要严格的进行药物晶型的监控,确定药物制剂中药物所属晶型是否会发生转变,倘若发生了晶型的转变是否会对药物制剂产生影响,如溶出,生物利用度等,进而对于最终上市产品晶型制定相应的标准。
小结:
新药开发以稳定固态形式开发依旧是第一选择目标,但是,不同的项目也是具有其独有的特色,如何在不变中以应付万变,才是我们解决问题的真章。循序渐进的固态形式转变,根据产品特点,即使临床伊始未采用所谓的优势晶型,临床开发期间采用不同的固态形式,上市之前终得最佳;主动固态形式转变,从多晶型角度抑或通过无定形固态分散体形式,给予产品以新的生命力,延长药品全生命周期;被动固态形式转变,令人诚惶诚恐,是新药开发最不想发生的事之一,如果发生了,也应从机理上,从根本上,进行痛彻的分析,以思控制之道。
一个药物往往可以具有多种固态形式(多晶型,盐型,共晶及无定形),同一固态形式下又存在稳定型亚稳定型,即使同一API制备的无定形形式也可能具有不同的形式,这种现象称为无定形的多态性。当然,在药物开发过程中,只有有效且相对稳定可接受的晶型能够作为药物被开发。不同的固态形式/晶型由于分子排列方式不同,导致晶体内部分子间的作用力以及表面性质产生差异,从而引起各种理化性质,如溶解度、熔点、密度、硬度等的变化,并引起药物的溶出速率、稳定性等的质量差异和产品的流动性、可压缩性、凝聚性能等加工性能的差异,进而影响药物的生物利用度和疗效。即使一个药物分子具有良好的安全性,有效性,倘若固态形式选择不合适,依旧具有失败的风险,希望此文可以引起大家关注,而药物开发中的晶型问题可以引起大家的重视。若有不妥之处,还请指教!
相关阅读:
参考文献:
1. Drug Development& Delivery 2018
2. FDA EMA
3. 晶型药物研发理论与应用
4. 一文详谈|丙肝DAA药物索磷布韦:从基础到应用
5.两个抗病毒化合物的联用制剂
7. 创新性药物研发过程中药学变更的相关考虑
<END>







收藏
登录后参与评论