2023年1月16日,
先声药业集团有限公司(2096.HK,以下简称“先声药业”)宣布:与中国科学院上海药物研究所、武汉病毒研究所联合开发的
3CL蛋白酶抑制剂——SIM-0417(先诺特韦片/利托那韦片组合包装)(先诺欣®)新药上市申请(NDA)获国家药品监督管理局(NMPA)以药品特别审批程序受理,拟用于治疗轻至中度新型冠状病毒感染(COVID-19)成年患者。该药非常重磅,来头不小,位列3CL蛋白酶抑制剂研发第一梯队,此次是
国产首个报上市的。
截图来源:药融云全球药物研发数据库
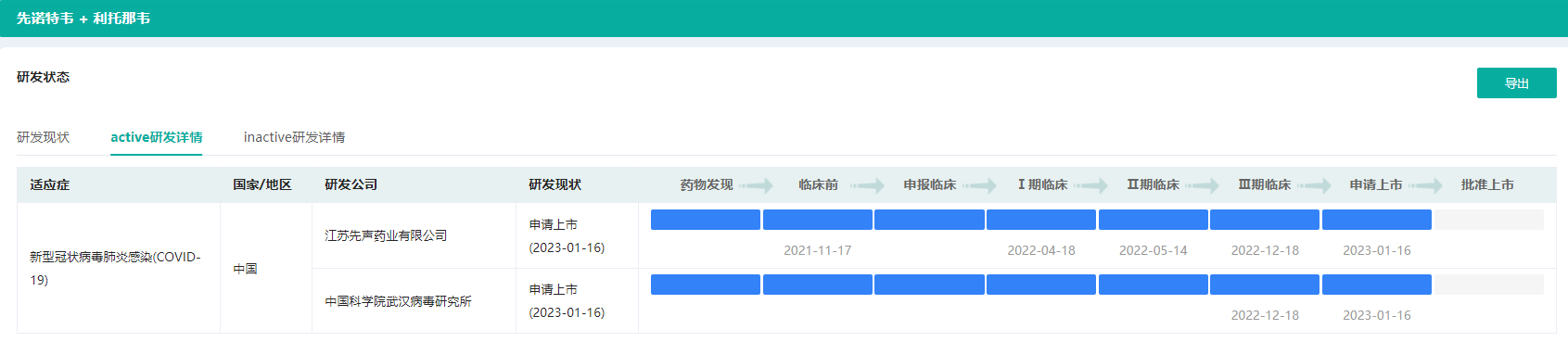
一、三方合力研发的国产3CL蛋白酶抑制剂
先诺欣®是一款3CL蛋白酶抑制剂,其作用机制与辉瑞已上市的Paxlovid相同。先诺欣®是由先诺特韦片与利托那韦片组合包装的药物,其中先诺特韦针对SARS-CoV-2病毒复制必须的3CL蛋白酶,与低剂量利托那韦联用有助于减缓先诺特韦在体内的代谢或分解,提高抗病毒效果。在临床前动物试验中,先诺欣®显示出高效、广谱抗新冠病毒活性,未发现遗传学毒性。
截图来源:药融云全球药物研发数据库
2021年11月17日,先声药业与中国科学院上海药物研究所、武汉病毒研究所就该3CL蛋白酶抑制剂订立技术转让合同,先声药业获得先诺特韦在全球开发、生产及商业化的独家权利。2022年3月28日及5月13日,先诺欣®分别获国家药品监督管理局签发的2项药物临床试验批准通知书。2022年8月19日,一项评估先诺欣®治疗轻中度COVID-19成年感染者的有效性和安全性多中心、随机、双盲、安慰剂对照的Ⅱ/Ⅲ期临床研究达成首例患者入组,2022年12月16日完成全部1208例患者入组。
截图来源:药融云全球医药交易数据库
先诺欣®注册临床研究由中国医学科学院、国家呼吸医学中心王辰院士、中日友好医院曹彬教授牵头,复旦大学附属中山医院樊嘉院士、复旦大学附属中山医院感染病科主任胡必杰教授共同指导完成,是第一个针对中国人群感染奥密克戎毒株的大样本临床试验,也是国内外第一个针对奥密克戎毒株感染者达成“以咳嗽、鼻塞流涕、咽痛、发热、头痛、肌肉或全身痛等11个症状持续恢复”为主要终点的III期注册临床研究。本项注册临床研究共纳入全国20个省市自治区43家临床参研中心,在深圳第三人民医院院长卢洪洲教授、武汉金银潭医院院长黄朝林教授等多位临床专家的大力支持下,快速而高质量完成了全部1208例患者临床试验。
关于本项注册临床研究有效性、安全性的详细数据将在产品批准上市后公布或公开发表。本项目I期临床试验在山东千佛山医院赵维教授指导下完成。
二、新冠病毒"克星"——3CL蛋白酶抑制剂
3CL蛋白酶(3C-likeprotease,3CLpro)在病毒自身编码中剪切和加工RNA的主要蛋白酶,目前已在12种病毒中发现3CL蛋白酶。其中在COVID-19病毒中,目前已有167条晶体结构数据。由于病毒的3CL蛋白酶和人的3CL蛋白酶的切割位点不一样,所以设计药物的特异性更好,潜在可设计出特异性更好的药物。
目前在3CL蛋白酶抑制剂研发领域的代表药物是辉瑞的Paxlovid,该药最早于2021年12月22日在美国面世,后又陆续在英国、欧盟、日本、韩国、巴西等多国获批。Paxlovid具有3CL蛋白酶这种病毒增殖所必需的酶,通过选择性地抑制3CL蛋白酶,从而达到抑制SARS-COV-2增殖的效果。
辉瑞的Paxlovid已上市国家
截图来源:药融云全球药物研发数据库
在中国,Paxlovid于2022年12月30日获得国家药监局应急附条件批准进口注册,是国内第一款获批上市的新冠口服药,因其疗效好,被冠以新冠“神药”之名,寄托了许多人结束新冠疫情的希望。Paxlovid还参与了2022年医保药品目录谈判,2023年1月8日,国家医保局发布消息,遗憾的是Paxlovid因生产企业辉瑞报价高未能成功。
因Paxlovid临床治疗数据较为出色以及在研药企众多,3CL蛋白酶抑制剂一直以来备受关注,且被业内视为最为看好的小分子药物,经
药融云数据库查询显示,目前全球基于3CL蛋白酶抑制剂研发的新冠药物有40余款。获批上市的除辉瑞的Paxlovid外,还有一款仅在日本上市——
日本盐野义的
Xocova。
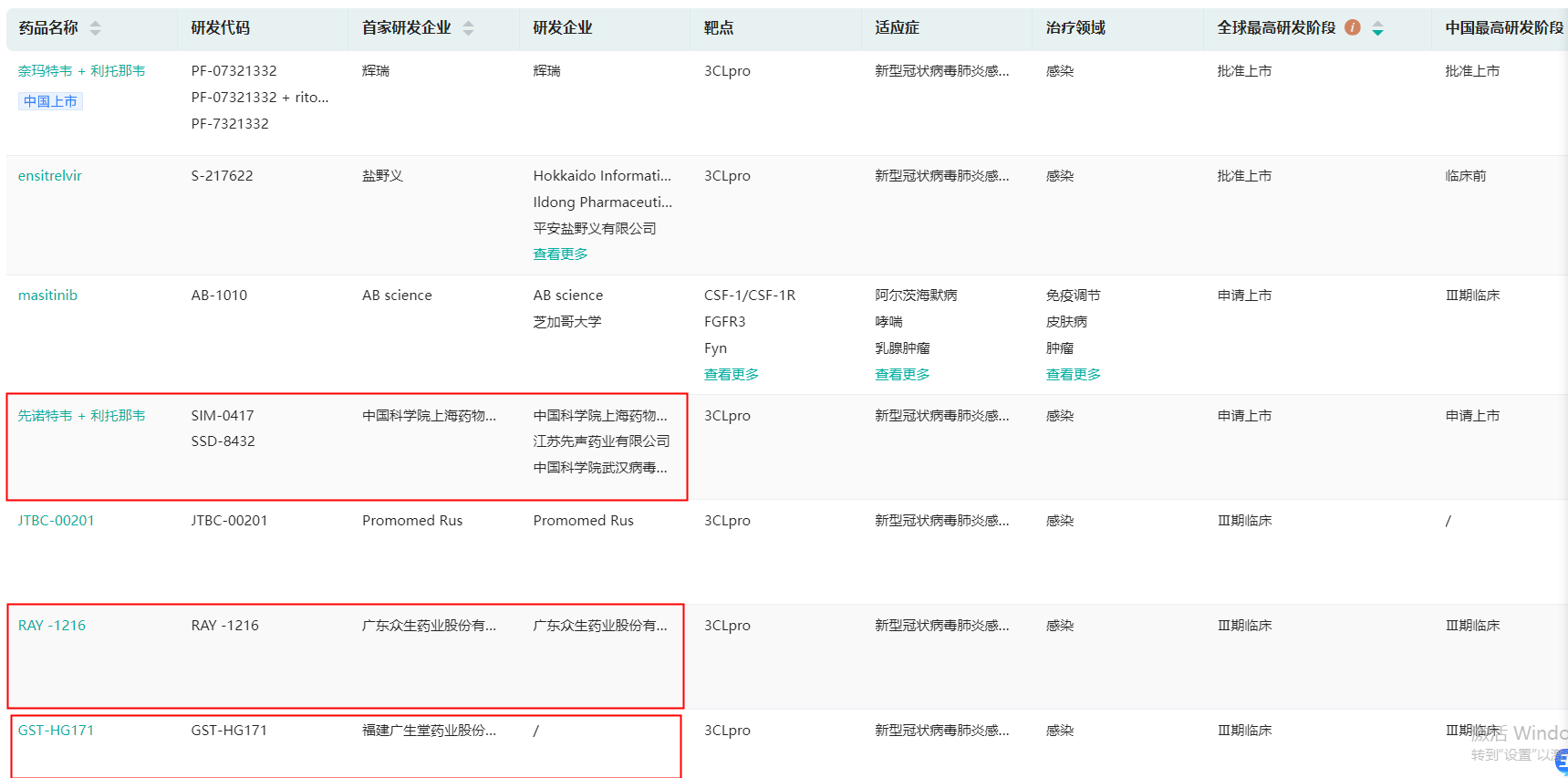
三、国产3CL蛋白酶抑制剂研发竞争格局
在国产的3CL蛋白酶抑制剂研发中,除先声药业的SIM-0417外,还有
君实生物的
VV-116、
众生药业的
RAY -1216、
云顶新耀的
EDDC-2214、
广生堂的
GST-HG171、
歌礼生物的
ASC-11等十多家企业的新药在研。其中,
先声药业、众生药业、广生堂进度领先,位列国产3CL蛋白酶抑制剂研发的第一梯队。
全球3CL蛋白酶抑制剂研发现状(部分)(红框内为国产)
截图来源:药融云全球药物研发数据库
来源:广生堂企业公告
这一临床结果是国产新冠药物研发的重大进展,证明了国产3CL蛋白酶抑制剂治疗效果不输Paxlovid,或成全球患者更优选。未来随着相关国内药企对
3CL蛋白酶抑制剂的步步推进,真正的“国货之光”新冠药物或将会诞生,走出国门,推向全世界,成为全中国人民的骄傲。
想要解锁更多药物靶点信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握各药物靶点药物基本信息、上市药物情况、销售情况与各维度分析、药企药物研发进展、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!!注册立享15天免费试用!
<END>
















收藏
登录后参与评论