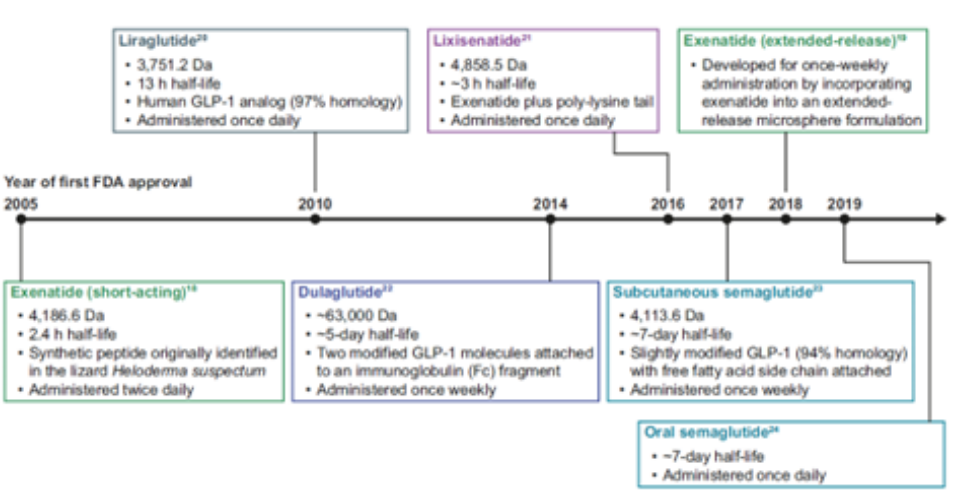
说起GLP-1的肽肽团们,大家可能并不陌生,从2005年FDA批准上市的第一款肽肽团成员艾塞那肽Byetta开始,目前全球已上市了10多款GLP-1类药物,而经过20多年的发展,肽肽团成员们也完成了华丽的转身[1]:由于半衰期仅为2.4h,艾塞那肽需要一天注射两次才能达到治疗的效果,为了提高患者的服药顺应性,诺和诺德于2010年推出了肽肽团成员中的第一个里程碑式产品– 利拉鲁肽Victoza,体内半衰期可达13h,每日注射一次便可达到降糖的效果,并在2015年获批用于肥胖症的治疗,即使在GLP-1神仙打架的今天,利拉鲁肽两款产品去年的销售额也达到了32.59亿美金。
之后礼来基于融合蛋白技术开发了首个一周给药一次的度拉糖肽Trulicity,并于2014年获FDA批准上市。2017年,诺和诺德在利拉鲁肽基础上推出了GLP-1历史上第二款重磅产品—司美格鲁肽,也是迄今最成功的长效GLP-1RA产品,2022年全年销售额109亿美金。而礼来也不甘示弱,在去年推出了全球首款GLP-1/GIP双靶点激动剂替尔泊肽Mounjaro。
而今年的肽肽团成员们也是异常的繁忙,总结来说,主要体现在以下三个方面:首先是口服化给药,因为目前大多数上市的GLP-1类产品都是通过注射的方式给药的,相比于注射而言,口服可以显著提高患者的服药顺应性;其次是多靶点协同,除了GLP-1R之外,胰高血糖素受体(GCGR)、葡萄糖依赖性促胰岛素多肽受体(GIPR)、成纤维细胞生长因子21受体(FG21R)等也在这些代谢过程中扮演了重要的角色,多项临床数据证明多靶点协同可以更好的控制血糖和体重;三是扩展新适应症,除了降糖和减肥的基本属性外,GLP-1类药物还在积极开展新的适应症,如非酒精性脂肪性肝炎(NASH)、心血管疾病领域、慢性肾脏疾病(CKD),甚至阿尔茨海默症(AD)。
1.口服化给药
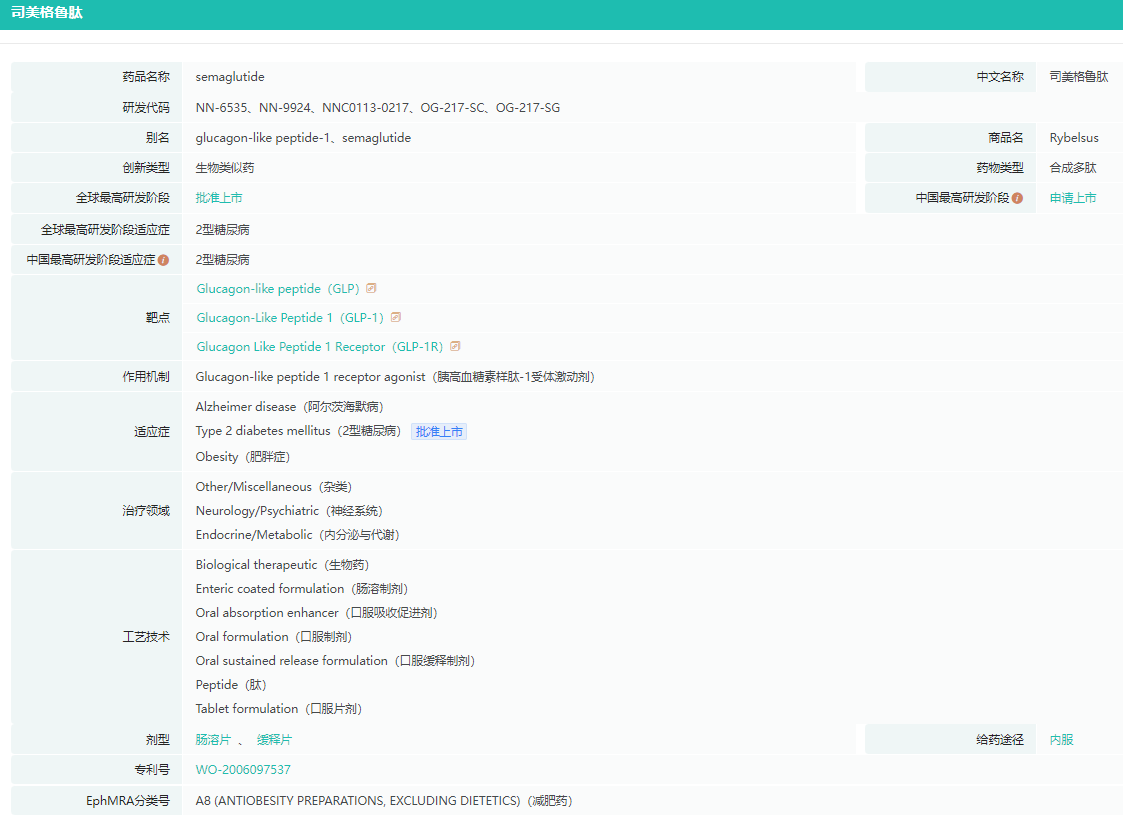
目前口服GLP-1的研发分为两个方向,一是口服大分子GLP-1药物,代表药物为诺和诺德上市的司美格鲁肽Rybelsus,也是全球上市的唯一一款口服GLP-1药物。
司美格鲁肽药物基本信息查询
截图来源:药融云全球药物研发数据库
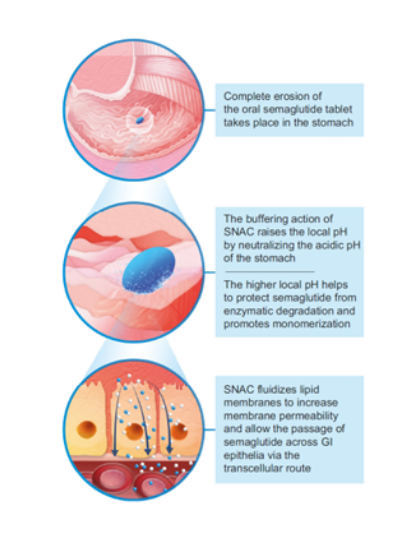
其实口服多肽并不是一个新概念,早在1923年就有人尝试以酒精做溶剂对胰岛素进行口服递送[2],然而100多年过去了,全球仍未有一款口服胰岛素产品上市,足见口服多肽类药物研发的难度之高。部分文献表明,当开发分子量超过1,000 Da的口服多肽时,需要克服的障碍包括胃肠道中酶的降解、pH诱导的构象改变、肠道上皮有限的透过性以及胃肠道吸收率的变化[3]。而口服司美格鲁肽的成功开发则主要归功于Emisphere公司于20世纪90年代开发的吸收促进剂SNAC,即Sodium N-(8-[2-hydroxybenzoyl]amino) caprylate。
如下图所示[1],当司美格鲁肽片在胃内崩解后,SNAC首先发挥缓冲作用,通过中和周围胃酸来升高局部pH值,从而降低司美格鲁肽的酶促降解;其次SNAC通过流化细胞膜来增加胃肠道上皮细胞的透过性,从而使司美格鲁肽通过跨细胞途径吸收。
除了口服大分子GLP-1类药物的开发,目前全球也有多个公司在进行口服小分子GLP-1类药物的研发,如礼来、辉瑞、恒瑞、华东医药和先为达生物等。
但令人遗憾的是,虽然口服小分子GLP-1的研发开始的较早,但截止目前还未有任何一款产品上市,目前全球研发进度较快的为礼来的Orforglipron,已在全球已开展了多个Ⅲ期临床,如针对2型糖尿病的ACHIEVE系列以及针对肥胖症的ATTAIN系列临床。
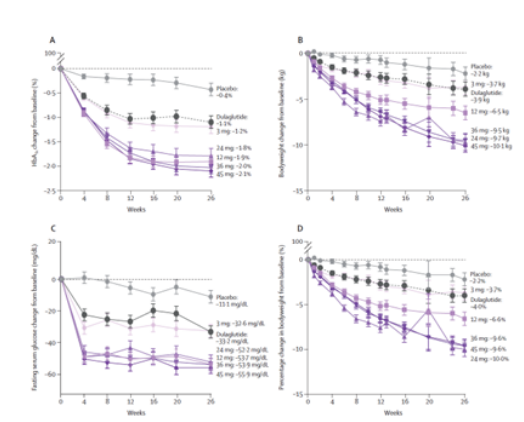
根据礼来临床Ⅱ期披露的数据我们可以看到,相比于安慰剂和每周注射1.5mg度拉糖肽,Orforglipron在控制血糖和体重方面表现出优异的效果:给药26周之后,糖化血红蛋白(HbA1c)的降幅均优于安慰剂,其中口服45mg Orforglipron的降幅最高,达到了2.1%(图A)。
而在减肥方面效果同样显著,口服3mg和45mg Orforglipron 26周之后患者体重分别降低了3.7kg和10.1kg,降幅分别为3.7%和9.6%。虽然效果优异,但我们仍需关注Orforglipron的安全性问题,因为不管是严重恶心和呕吐的发生率,还是一般不良反应的发生率,Orforglipron均高于安慰剂和度拉糖肽,因此口服小分子GLP-1能否杀出重围,还需更多的临床数据。
2.多靶点协同
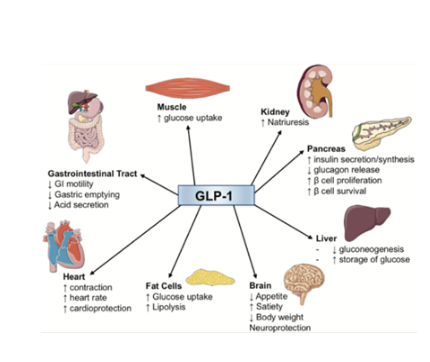
诺和诺德的网红药司美格鲁肽,属于GLP-1R激动剂,为单靶点药物。GLP-1受体即胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)受体,如下图所示广泛分别于身体的多个器官和组织中。而这其中GLP-1介导的生物活动最佳的靶器官分别是胰腺、胃肠道、中枢及外围神经系统。
在胰腺中,激动GLP-1受体所产生的生物活动包括刺激胰岛素的合成与分泌、促进β细胞的增殖和存活并抑制α细胞分泌胰高血糖素,从而达到控制血糖的目的;在胃肠道系统内,激动GLP-1受体则会强力抑制胃排空和胃肠蠕动,增加饱腹感;而在大鼠实验中科学家们发现,中枢递送GLP-1类药物后会短暂降低大鼠的食物摄入,而这与胃内是否存在食物和胃排空是无关的,并且外围神经给药也同样会影响食物摄入,因此种种结果表明中枢和外围神经在调节饱腹感时存在协同作用,从而最终达到减肥的效果[1]。
除了GLP-1受体之外,科学家们发现胰高血糖素受体(GCGR)、葡萄糖依赖性促胰岛素多肽受体(GIPR)、成纤维细胞生长因子21受体(FG21R)等也在身体代谢过程中扮演着重要的角色,因此双靶点或三靶点药物自然而然就成为了目前的研发热点。
这其中代表性药物为礼来公司上市的GLP-1R/GIPR双靶点药物替尔泊肽Mounjaro,该药物于2022年陆续在美国、欧盟和日本获批上市,在今年上半年便斩获15.48亿美金的销售额。
根据10月15日礼来公布的完整的SURMOUNT-3的Ⅲ期临床试验结果我们可知,替尔泊肽除了降糖外还具有优异的减重效果:如下图所示,在12周强化生活方式干预导入期后,替尔泊肽组受试者平均减重6.9%(7.6kg或16.8磅)。
导入期结束72周后,替尔泊肽组受试者额外实现平均减重21.1%,而安慰剂组受试者体重却升高3.3%。同时替尔泊肽组有94.4%受试者实现了体重减轻≥5%,而安慰剂组却仅为10.7%。在次要临床终点方面,替尔泊肽组有54.9%的受试者体重降低达20%及以上,而安慰剂组却仅为1%。并且在安全性方面,并未发现新的安全性问题,其最常见的不良反应仍是恶心、腹泻和便秘等[4]。
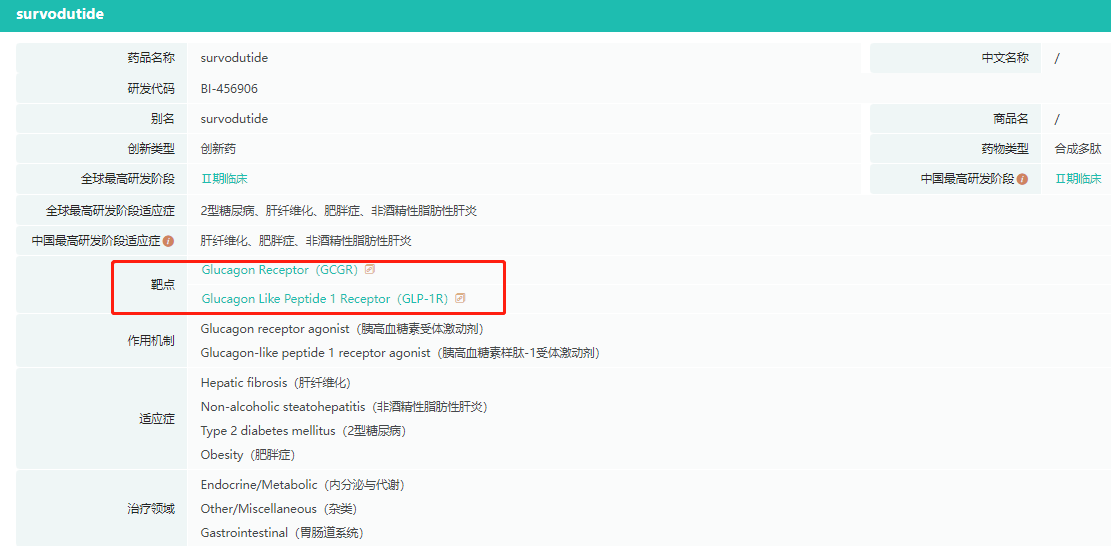
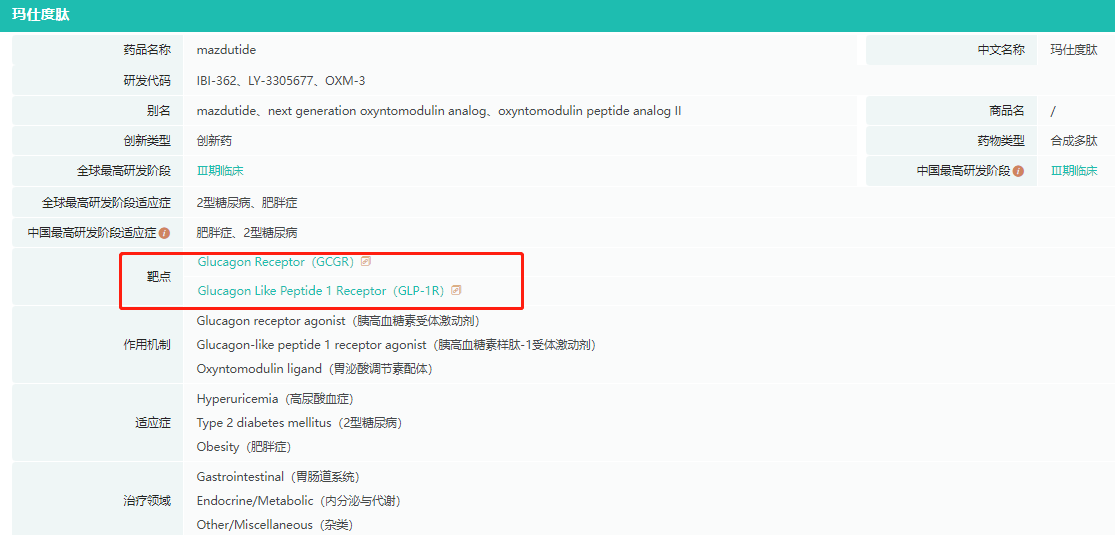
除了礼来的替尔泊肽,目前全球也有多款多靶点药物处于临床阶段,如BI的GLP-1/GCGR双靶点药物BI456906,礼来的GLP-1/GIPR/GCGR三靶点药物LY3737943,信达生物的GLP-1/GCGR双靶点药物Mazdutide,以及恒瑞医药的HRS9531以及SHR-1816等,在此不再赘述。
BI456906基本信息
截图来源:药融云全球药物研发数据库(下同)
Mazdutide基本信息
3.拓展新适应症
如果要评出2023年制药届的“卷王”,那一定GLP-1类药物莫属,在卷完了糖尿病和肥胖症之后,GLP-1类药物又将触手伸向了更多疾病领域,如非酒精性肝炎NASH、心血管疾病、射血分数保留型心力衰竭HFpEF、阿尔茨海默症AD、慢性肾病和成瘾等。
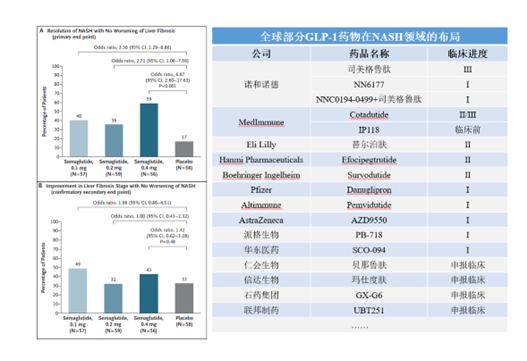
这其中,NASH是GLP-1类药物除了糖尿病和肥胖症布局最多的适应症,目前进度最快的为诺和诺德的司美格鲁肽,已进入Ⅲ期临床,从其披露的Ⅱ期临床数据我们可以看到,相比于安慰剂的17%而言,每日接受0.1mg、0.2mg和0.4mg皮下注射司美格鲁肽的患者在治疗72周之后,NASH症状消退且无纤维化恶化的患者比例分别为40%,36%和59%。
但值得注意的是,注射三种规格的司美格鲁肽治疗72周之后并未改善患者的肝脏纤维化等级(F2或F3),诺和诺德认为这或许可能与多数患者处于纤维化晚期且治疗时间不足有关,并且注射0.4mg司美格鲁肽,恶心、便秘和呕吐的不良反应发生率均高于安慰剂组。因此GLP-1类药物能否用于治疗NASH还需时间的检验。而除了诺和诺德之外,Medlmmune的Cotadutide,Hanmi的Efinopegdutide以及礼来的替尔泊肽等十多款药物也均处于临床阶段。
同样,在心血管领域司美格鲁肽也取得了不俗的战绩,2023年8月8日诺和诺德宣布,在SELECT临床Ⅲ期试验中,连续5年每周注射一次2.4mg司美格鲁肽,可使成年超重或肥胖症患者主要不良心血管事件(MACE)风险显著降低20%,具有统计学显著性和优效性,而MACE包含心血管死亡、非致死性心肌梗死或非致死性卒中。
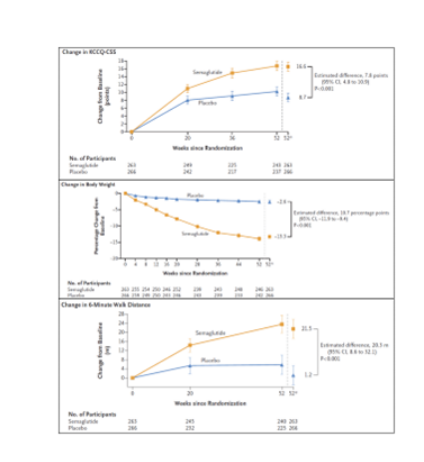
而在另一项Ⅲ期临床试验STEP-HFpEF中我们可以看到,对于HFpEF合并肥胖患者(BMI≥30 kg/m2),每周静脉注射2.4mg司美格鲁肽治疗52周之后,主要临床终点(KCCQ-CSS及体重变化)和次要临床终点(6分钟步行距离)均取得了令人满意的结果,其中司美格鲁肽组KCCQ-CSS分数平均变化为 16.6 分,而安慰剂组为 8.7 分(分数越高说明症状和身体功能改善越好);司美格鲁肽组患者平均体重下降13.3%,安慰剂组下降2.6%;6分钟步行距离变化中,司美格鲁肽组平均变化为21.5m,而安慰剂组仅为1.2m。由此可见司美格鲁肽或许可以为心血管疾病患者而提供一个新的治疗方案。
在
肾病领域,司美格鲁肽同样也是喜报连连,2023年10月10日,诺和诺德宣布将提前终止司美格鲁肽用于在2型糖尿病和慢性肾病患者中延缓肾损伤的临床试验FLOW,理由是独立数据监查委员会(DMC)在对试验数据的中期分析时认为
司美格鲁肽的效果达到预先设定的提前终止试验的疗效标准。
而礼来的
度拉糖肽和替尔泊肽也紧随其后,目前处于临床Ⅱ期阶段;而对于人类已经攻坚多年但收获甚微的阿尔茨海默症AD,诺和诺德早在2021年就已经启动两项名为EVOKE和EVOKE Plus的大型III期临床试验,尽管目前尚未有任何临床数据支持,但大量文献表明,
GLP-1可能通过激活PI3K/Akt通路增强有氧糖酵解和减少氧化磷酸化作用,从而起到神经保护和能量调节的治疗作用。
或许,等肽肽团们忙完以后,我们会见证一个“包治百病”的神药的诞生。
参考资料:
1. Aroda VR, Blonde L, Pratley RE. A new era for oral peptides: SNAC and the development of oral semaglutide for the treatment of type 2 diabetes. Rev Endocr Metab Disord. 2022;23(5):979-994. doi:10.1007/s11154-022-09735-8.
2. Harrison GA. Insulin in alcoholic solution by the mouth. Br Med J. 1923;2(3286):1204–5. https:// doi. org/ 10. 1136/ bmj.2. 3286. 1204.
3. Anselmo AC, Gokarn Y, Mitragotri S. Non-invasive delivery strategies for biologics. Nat Rev Drug Discov. 2019;18(1):19–40. https:// doi. org/ 10. 1038/ nrd. 2018. 183.
4. Wadden, T.A., Chao, A.M., Machineni, S.et al. Tirzepatide after intensive lifestyle intervention in adults with overweight or obesity: the SURMOUNT-3 phase 3 trial. Nat Med (2023). https://doi.org/10.1038/s41591-023-02597-w
5.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

















收藏
登录后参与评论