近日,国内又有多款针对奥密克戎的新冠疫苗获批,但是目前国内mRNA技术路线的新冠疫苗还没有一家获批(截止12月10日)。
新冠mRNA疫苗一直是业内关注的焦点。12月8日,有多家机构投资者对沃森生物进行了电话调研,公司详细介绍了mRNA技术路线的新冠疫苗近况。
沃森生物(300142)目前市值653亿元。2022年1-9月,公司实现营业收入37.06亿元,比上年同期增长74.06%,实现净利润5.31亿 元,比上年同期增长45.84%。
1、目前国内mRNA技术路线的新冠疫苗还没有获批EUA,公司是怎么考虑的?
疫苗具有一定的社会公共属性,尤其在当前疫情防控的大背景下。新冠mRNA疫苗作为创新技术产品,我国疫苗企业及研究机构在mRNA疫苗方面的研究起步稍晚,目前尚无国内企业有该技术路线的
新冠疫苗产品在国内上市,其上市审批需要更加充分的研究和论证。
目前公司正持续与CDE保持沟通,并按照要求补充相关材料和数据。
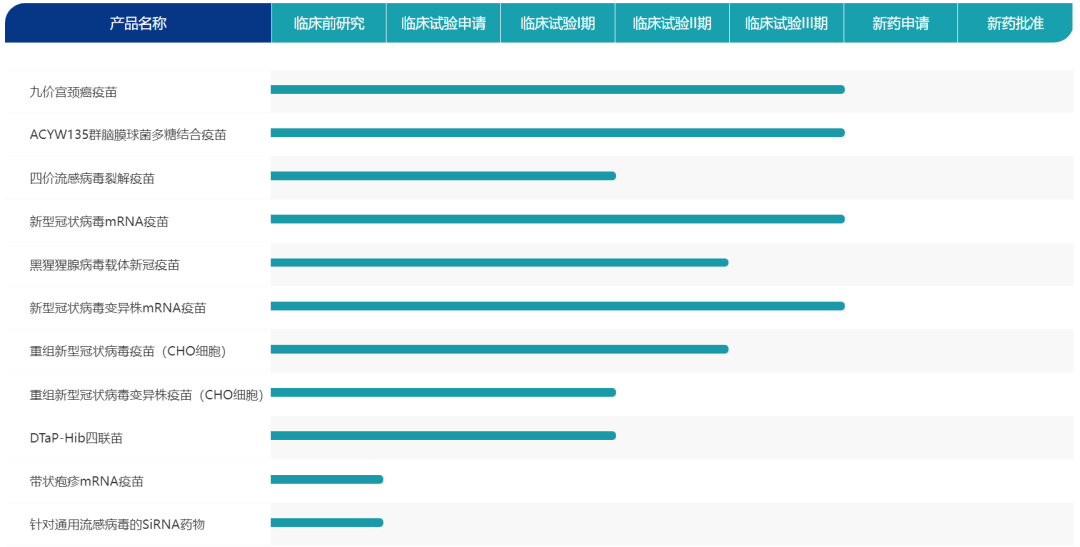
沃森生物(300142)在研管线
2、公司新冠mRNA疫苗目前在国内同类产品中相比怎么样?
公司与军科院和艾博生物合作的新冠mRNA疫苗已按照既定临床试验方案完成主要临床试验研究,在数据完整度、程序完备度、临床试验进度、可评判度等各方面都有更为夯实的基础,具有一定优势。公司与蓝鹊生物、复旦大学合作的新冠变异株mRNA疫苗作为二代苗,是一款针对新冠病毒变异株设计开发,编码全长S蛋白嵌合体 的创新型广谱新冠mRNA疫苗,该疫苗也是国内首个进入临床的mRNA嵌合体疫苗,达到了不弱于国际头部企业的技术水平。该疫苗抗原设计覆盖多种变异株的主要免疫逃逸突变位点,临床前研究表明, 该新冠mRNA疫苗具有良好的安全性、免疫原性和攻毒保护效果,对包括Omicron株在内的主要新型冠状病毒VOCs均具有一定的交叉中和能力,目前公司正按照标准推进Ⅱ期临床的收尾。同时,公司近期已分别在广州 医科大学附属第一医院、云南、广西启动Ⅲa期临床试验,并同步在云南启动Ⅲb期临床试验,相关工作也在按计划加速推进中。
沃森生物新冠mRNA疫苗管线
疫苗产品的有效性和安全性来源于充分审慎的抗原设计和工艺技术,而从产品设计到研发、临床、注册,再到产业化的全过程更加仰赖于一个企业的全产业链把控、产业化转换、成本控制能力,作为疫 苗企业核心竞争力的重要组成部分,沃森生物具有充足的准备与良好的基础。
3、公司新冠变异株mRNA疫苗的Ⅲa期和Ⅲb期进度怎么样了?
预计什么时候能出数据?临床试验涉及到现场入组、接种、采样、检测、数据整理分析等程序,公司会全力以赴推动临床试验的进度,Ⅲa期和Ⅲb期预计将于近期完成入组,后续有实质性进展公司会根据相关法规的规定履行信息披露义务。
4、公司研发新冠mRNA疫苗是从长远的平台建设考虑还是短期盈利为目的?
mRNA疫苗技术具有研发效率高、应对变异能力强和制造成本低等优势。公司始终坚持以创新驱动发展,通过对技术和市场需求的分析和判断,持续加大对创新产品路线的布局和投入,希望通过对未来 技术路线和国际市场的布局,为公司股东实现良好的经济回报。新冠疫情初期公司首先是基于疫苗企业的社会责任感和使命感及时启动相关研究,从长期来看,我们认为mRNA技术在未来有长远的发展前景,mRNA创新技术布局对于公司未来其他产品的研发上市具有重要意义。通过新冠mRNA疫苗的研发和产业化建设,公司已构建起独立可控的mRNA技术平台和研发能力,相较于国内竞争对手已经建立起一定的 竞争优势,未来将借助该技术加快公司核心疫苗产品的研发生产,例如目前公司与合作方合作的已处于临床前研究的流感mRNA疫苗、呼吸道合胞病毒
mRNA疫苗等。将来随着mRNA技术路径产品的上市, 预计能够为公司拓展广阔的海外市场创造良好条件。
5、公司九价HPV疫苗的Ⅲ期临床在已有双价HPV疫苗上市的基础上可以提速吗?
公司双价HPV疫苗已经获批上市,在政策支持下,预计能够推动九价HPV疫苗的研发上市进度。HPV 疫苗市场空间和竞争格局对公司来说较为有利,我们预判未来3-5年内竞争格局暂时还不会有太大改 变,目前二价HPV疫苗仍然有很好的机会。
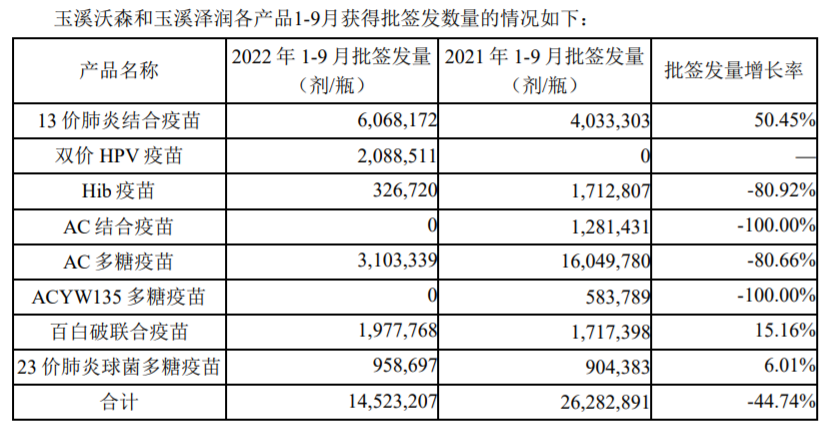
6、13价肺炎结合疫苗未来还有多大的市场提升空间?公司对明年的市场开拓和销售有什么计划?
随着大众健康意识的持续提升和国家政策的鼓励,再加上本次疫情对大家健康意识和疫苗认知提升的促进作用,我们认为在未来可预见的相当时期内,13价肺炎结合疫苗仍有很大的市场提升空间,整个市场整体上还是可以有很好的增长率。公司目前已经建立了良好的市场基础和销售渠道,未来3年公司依然有信心保持高于行业平均增速以上的增长。
明年公司将继续从销售体系建设、消费者教育、终端服务和渠道 布局多维度打造产品品牌和市场影响力。公司将积极配合并参与国内各省市HPV疫苗试点计划和推广普及工作的推进,实现对全国主要地 区的全覆盖,同时继续加速13价肺炎结合疫苗在国内市场销售放量。在国际市场方面,针对中等和中低收入国家市场,公司的开拓重心是东南亚(如印尼、泰国)、中东及北非、南美等地区人口增长快、体量较大的国家。
今年13价肺炎结合疫苗获得了摩洛哥注册证,实现了海外销售零的突破,国际营销团队也在与多个意向国家接触,并同步开展部分目标国家的注册准入工作,拟通过多样化的合作方式加快实施公司海外布局。双价HPV疫苗的WHO- PQ认证世卫组织已受理,13价肺炎结合疫苗正进行PQ申请前的准备。
资料来源:
[2] 药融云数据库vip.pharnexcloud.com/?zmt-mhwz
<END>








收藏
登录后参与评论