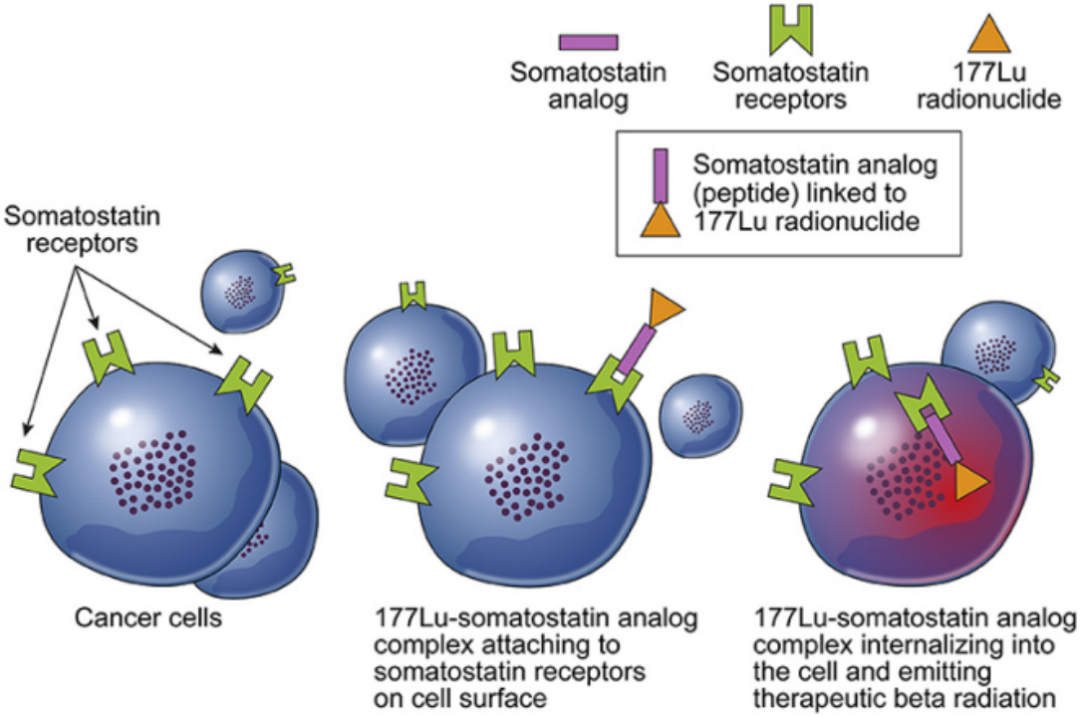
一个显而易见的趋势,放射性核素在各种情况下的应用增加。核素是放射性同位素的简称,指可以产生α、β或γ放射线的金属或非金属元素。核素在体内靶向放疗中的作用:核素标记的药物(核药)在肿瘤病变部位浓聚,利用核素发射出的α、β或γ放射线,消灭那些癌变的细胞,从而达到治疗的目的。
由于放射性,使核药成为特殊高门槛的存在:研究开发、临床试验、生产、使用都受到严格监管。临床试验需要专业的资质条件、丰富的核医学诊疗经验、伦理委员会保障及科学规范的试验机构管理,更需要院企之间更有效的相互合作,去推动核药的发展与转化。
镥[177Lu]氧奥曲肽注射液(lutetium Lu 177 dotatate)此前获批
用于不可切除或转移性、进展性、分化良好(G1及 G2)、生长抑素受体阳性的成人胃肠胰神经内分泌瘤(GEP-NETs)的治疗。这是
FDA批准的第一个放射性多肽靶向肿瘤治疗药物(Pepide Receptor Radionuclide Therapy,PRRT)。LUTATHERA分子内的奥曲肽可以与肿瘤细胞表面的生长抑素受体结合,将放射性177Lu运送到细胞内部,通过发射β射线对肿瘤细胞造成损伤。
Advanced Accelerator Applications (AAA)公司原研开发的一款核药——
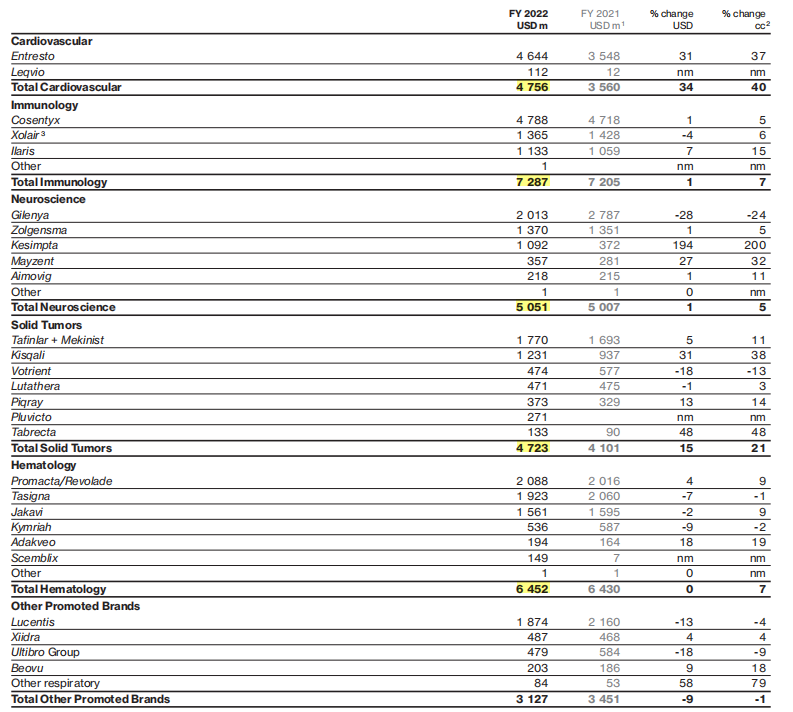
LUTATHERA,是一种由放射性核素镥[177Lu]标记的生长抑素类似物, 2017年10月在EMA批准上市, 后分别于2018年1月和2021年在FDA和日本批准上市。2020年LUTATHERA为诺华带来超4.45亿美元收入;2021年全球销售 额合计约 4.75亿美元。
药融云数据库,vip.pharnexcloud.com/?zmt-mhwz显示:截止2022年底,该核药全球有近500家合作的治疗中心可惠及患者,销售额4.71亿美元。
Advanced Accelerator Applications最早于2002年在法国成立,从欧洲核子研究组织中分拆。通过自主研发与收购构建了涵盖8种诊断核素药物和1种核素治疗药物的管线,以及多个先进的生产基地。后被诺华制药39亿美元收购。
一、恒瑞医药核药最新获批临床
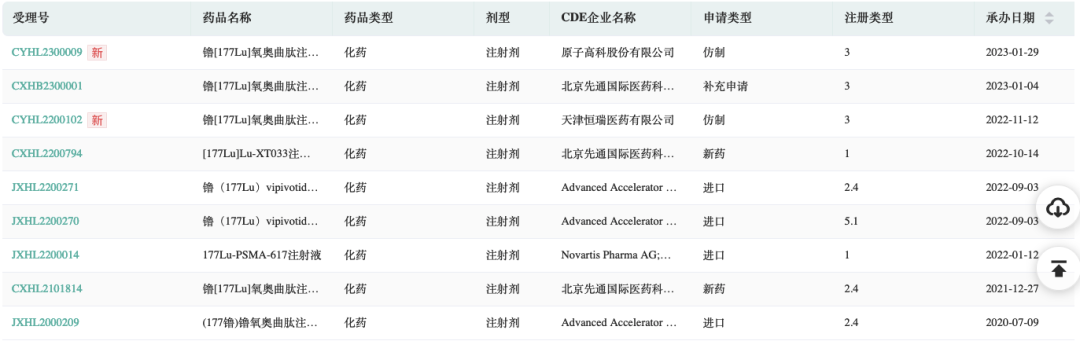
药融圈获悉:近日,江苏恒瑞医药股份有限公司子公司天津恒瑞医药有限公司(成立于2020年)收到国家药品监督管理局(NMPA)核准签发关于镥[177Lu]氧奥曲肽注射液的《药物临床试验批准通知书》,将于近期开展临床试验。
药物名称:镥[177Lu]氧奥曲肽注射液
剂 型:注射剂
申请事项:临床试验
受理号:CYHL2200102
审批结论:根据《中华人民共和国药品管理法》及有关规定,经审查,2022年11月11日受理的镥[177Lu]氧奥曲肽注射液符合药品注册的有关要求,同意本品开展临床试验。
目前国内尚无原研及同类产品获批上市,原研核药2020年申请进入中国,于2021年4月获得NMPA的临床试验批件。截至2023年1月,恒瑞医药镥[177Lu]氧奥曲肽注射液累计已投入研发费用约2,057万元人民币。
神经内分泌肿瘤(Neuroendocrine Neoplasm,NEN)是一组起源于分布全身的神经内分泌细胞的异质性肿瘤。其中以胃肠胰神经内分泌肿瘤(Gastroenteropancreatic Neuroendocrine Neoplasm, GEP-NEN)最为常见,约占所有NEN的2/3。在欧美国家,GEP-NEN发病率呈逐年升高的趋势,据我国肿瘤登记办公室公布的基于中国人群的癌症监测点数据,NEN在中国人群的发病率为4.1/10万。
二、先通医药核药进入关键阶段
药融云数据库显示:此外,中
国工程物理研究院核物理与化学研究所/
先通医药合作开发的一款
核药——
镥[177Lu]氧奥曲肽注射液,目前已进入了关键3期临床阶段,组长单位中国人民解放军总医院第一医学中心。
原子高科股份有限公司的本品申报临床试验,并获得CDE受理公示。
截图来源:药融云中国临床试验数据库
2022年先通医药新增4个项目XTR015、XTR016、XTR017,XTR018。其中XTR016和XTR017是公司早期研发团队开发的具有全新分子结构的全球1类
创新药。截至2022年底,先通医药在研创新项目超15个,其中2个处于NDA审评阶段、4个已进入临床试验阶段。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据,vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
https://data.eastmoney.com/notices/detail/600276/AN202301311582555513.html;
https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm594105.htm;
https://www.novartis.com/news/media-releases/novartis-continues-grow-further-core-margin-expansion-and-achieves-important-innovation-milestones;
胃肠胰神经内分泌肿瘤诊治专家共识(2020·广州)[J].中华消化杂志,2021,41(02):76-87;
徐建明,梁后杰,秦叔逵,楼文晖.中国胃肠胰神经内分泌肿瘤专家共识(2016年版)[J].临床肿瘤学杂志,2016,21(10):927-946;
物理研究院核物理与化学研究所,https://mp.weixin.qq.com/s/4p6RvCPhX7KIxF_NN16bWA;等等。
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
<END>

















收藏
登录后参与评论