药融圈获悉,绿叶制药集团控股子公司——
山东博安生物技术股份有限公司(博安生物)于5月13日向香港联交所提交上市申请,申请公司H股股份于香港联交所主板上市及买卖。瑞银集团(UBS)、安信国际为联席保荐人。
成立于2013年的博安生物致力于在中国及全球开发、制造及商业化优质生物药,为肿瘤、代谢、自身免疫及眼科等常见主要治疗领域提供创新、可及的治疗方案。经过多年积累,博安生物凭借差异化的产品组合、全面综合性生物制药平台、以及不断成熟的商业化能力培育起自身独特的竞争优势。
产品管线丰富,均衡商业能见度与“创新力”
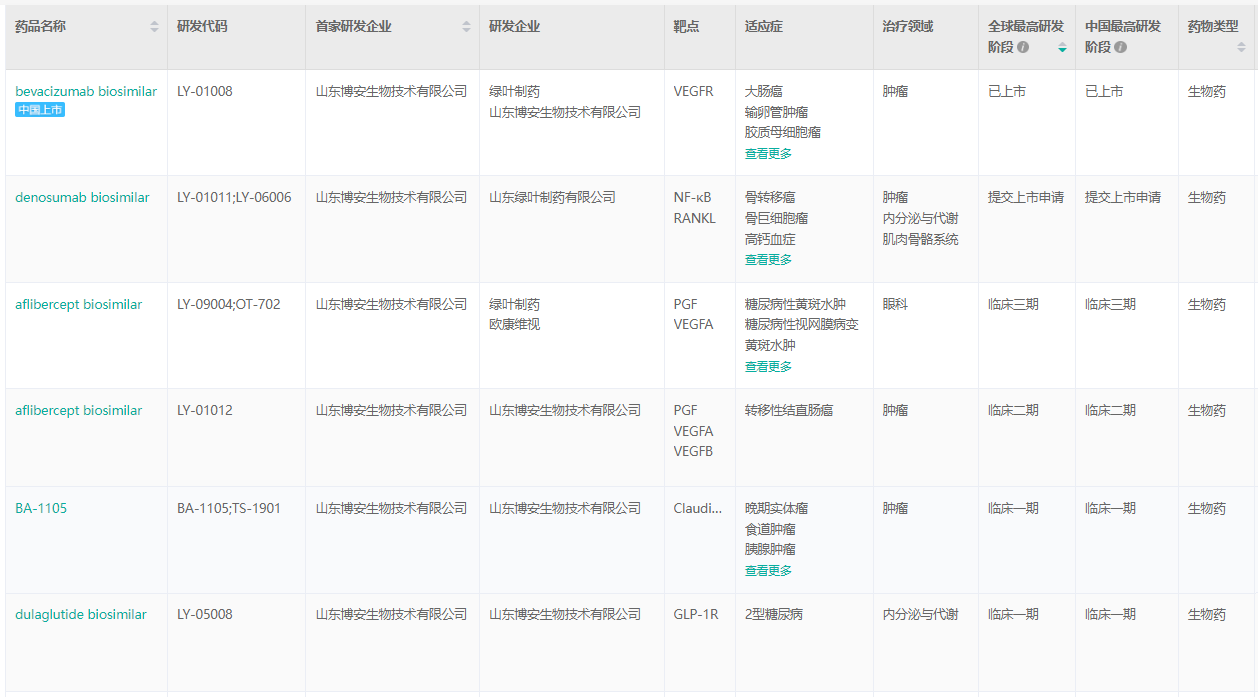
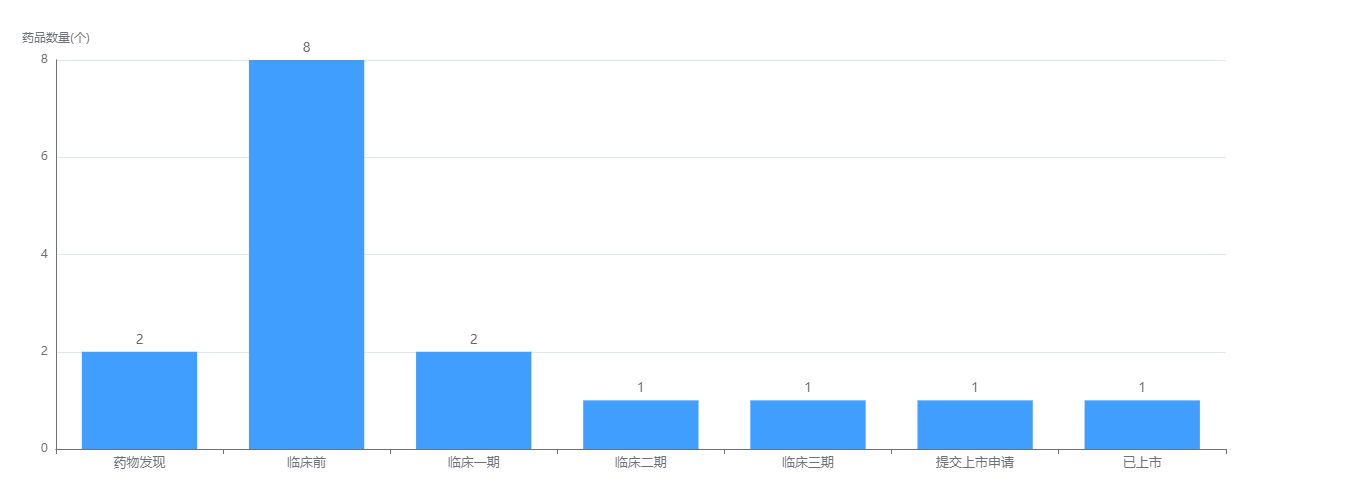
据博安生物首次提交的招股书披露,公司的产品管线涵盖创新抗体和生物类似药,现有1款商业化产品、5款在研生物类似药、7款在研创新抗体。博安生物采取这一产品组合策略的用意较明显:若干临近商业化阶段的生物类似药为短期的商业化提供明确路径,而更多前沿创新靶点为长期的可持续发展奠定良好根基。据药融云数据库显示,博安生物目前在已上市、提交上市申请、临床3\2期试验,均有一款产品在研。另外值得一提的是,在药物发现阶段有8款之多。
博安生物部分药物研发管线(临床一期及以上)
截图来源:药融云全球药物研发数据库
博安生物药物研发阶段
截图来源:药融云全球药物研发数据库
生物类似药:速度优势显著
博安生物瞄准的生物类似药均为市场巨大的潜力品种,且在速度上具备先发优势:除了已实现商业化的
博优诺®(贝伐珠单抗注射液),还有5款在研生物类似药,多个品种的研发进度在国内处于第一梯队、速度优势显著,招股书中透露称,若干品种有潜力首批上市。
招博安生物股书披露,临近商业化阶段的多个品种包括:代谢领域的 BA6101(地舒单抗注射液,普罗力®生物类似药)的生物制品许可申请(BLA)于2021年10月获国家药监局受理,预期其将于2022年下半年获批上市;肿瘤领域的 BA1102(地舒单抗注射液,安加维®生物类似药)在华处于III期临床,预期将于2022年下半年提交BLA;眼科领域的 BA9101(阿柏西普)也在华处于III期临床,预期将于2023年提交BLA。除了在中国,公司还基于这些品种在海外市场的商业潜力推进海外市场的开发。如BA6101、BA1102在欧盟处于1期临床。
创新抗体:建立在更高成功概率上的新药开发
博安生物策略性地开发候选创新抗体以专注于具有庞大市场潜力的新制剂。为了强化研发确定性、加快临床开发速度,博安生物构建了兼顾成功率与创新价值的创新抗体产品组合。
处于临床阶段的创新抗体包括:新冠中和抗体LY-CovMab已在中国处于II期临床阶段,展现良好的治疗潜力;ADCC增强型Claudin18.2靶向的全人源单克隆抗体BA1105在中国处于I期临床,有望成为同类治疗转移性胰腺癌和晚期胃癌及食管胃交接部腺癌的最佳靶向药物;抗PD-L1/TGF-β双功能融合蛋白BA1201是博安生物首个获批启动临床试验的双特异性抗体,能够同时对两种靶点相结合,对两种癌症治疗相关的信号通路进行调节,在肿瘤免疫治疗方面具有独特优势。
此外,另有广谱免疫肿瘤药物CD25抗体BA1106、抗肿瘤CEA/CD3双抗BA1202、抗Claudin18.2 抗体药物偶联(ADC)BA1301、自身免疫治疗领域的IL4R长效分子抗体BA2101,博安生物计划在今明两年陆续提交上述候选创新抗体的新药临床试验申请(IND)。
立足自有平台优势,生物制品全产业链价值凸显
产品管线的高效推进,得益于博安生物自身的核心竞争优势,即:全面综合性及可扩展的生物制药平台,这一平台由专注于肿瘤、代谢、自身免疫及眼科的先进研发技术以及强大生产及商业化能力赋能,博安生物将这一平台优势延伸至生物制品全产业价值链。
在药物发现方面,博安生物分布于烟台、南京和波士顿的全球化研发团队通过三大先进技术平台建立技术优势:1)全人抗体转基因小鼠及噬菌体展示技术平台:博安生物是中国少数拥有自主转基因小鼠平台的公司之一。全人抗体转基因小鼠BA-huMab®能够显著加快抗体发现过程并降低免疫原性风险,通过该平台,博安已成功发现超过10个靶点的具有高亲和性及高特异性的潜在候选药物;博安噬菌体展示技术平台提供一个成熟、先进的噬菌体库构建技术。其噬菌体库质量受严格控制,免疫库容量大于10 亿,序列准确率高于95%。2)双特异T-cell Engager技术平台:通过二价结合肿瘤靶抗原展现出高活性以实现更佳药物疗效,通过单价结合T细胞实现低亲和力结合以降低毒性,降低与CD3结合的亲和力以降低CRS(细胞因子释放综合征)的风险。3)ADC技术平台:涵盖整个ADC发现及开发过程,能有效快速地发现及开发ADC候选产品,使博安生物的平台及产品组合更多样化。
博安生物以强大的CMC能力为整个药物开发及商业化生产程序中的高质量及成本效率保驾护航,在保持产品质量的实际定性及定量标准的同时,高效地将产品从药物发现过渡至实际生产,可缩短药物开发时间,形成区别于竞争对手的优势壁垒,为博安生物产品的首发优势铺路。
首款产品博优诺®,验证强大商业化能力
依托首款产品博优诺®的顺利上市,博安生物已建立起广泛的商业化网络和成熟的商业化能力。在2021年只有几个月的实际可销售时间里,博优诺®实现销售收入1.587亿元人民币;截至目前,其分销网络覆盖全国979家医院。不仅如此,通过博优诺®的商业化,博安生物打通了研发-制造-商业运营各个环节,为其后续在研产品实现加快上市、产品的迅速上量奠定良好基础。
通过卓越的业务拓展能力,博安生物积极携手各位优质的合作伙伴,借助其丰富的资源,将产品的临床价值和市场潜力最大化。包括:授予阿斯利康中国在各省市及自治区的多个县域地区独家推广博优诺®;与欧康维视就BA9101在中国的产品开发、推广及商业化展开合作等。多元化商业化策略推进下,博安生物正在逐步形成国内市场、海外市场、对外授权等多方向并行的商业化形态。
相对其他Biotech面临的商业化能力这一巨大短板与挑战,博安生物在商业化能力上的天然优势,或成为助力其快速脱颖而出的又一保障。
小 结
招股书显示,博安生物是中国为数不多的能够从最初药品发现及开发到最终提交BLA并实现产品商业化的生物制药公司;未来三年,预计将有多个产品陆续提交生物制品许可申请,若推进顺利,这将大大增加博安生物的“造血能力”, 这也是其从Biotech向Biopharma进阶的关键时期。
事实上,博安生物近年来在管线推进速度、全产业链建设等均可谓是可圈可点,放眼当下通过18A上市的Biotech,
博安生物确实“自带光环”——毕竟少有公司在递交上市申请时便有过亿的产品销售额,公司正展现出蓬勃发展势头,相信此次赴港上市将助力公司加速驰入高质量发展快车道。
想要解锁更多药企信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、最新进展、临床研发阶段、市场规模与前景;仿制药申报情况、市场竞争格局、销售情况;公司投融资情况、年报与前景,可否投入!注册立享15天免费试用和虎年首份医药数据大礼包! <END>








收藏
登录后参与评论