声明:因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及);本文不构成任何投资建议。
引言
CDE官网改版已经一月有余,相比于旧版,新版CDE网站使用更方便,模块更清晰。近期,CDE新闻中心也发布了一系列不得不看的新闻。那都有哪些重点呢?小编针对部分新闻做了梳理和总结,详情见下。
1.创新药申报破纪录,形势大好
统计药审中心数据,发现截止2021年9月CDE已承办35品规1类创新药的上市申请(图1)。且2021年上半年已有21个1类创新药获批上市,这一数字已经超过2020年全年20个创新药审评通过数量,这也意味着我国在创新药审评上刷新了记录。分析这21品规的创新药包括新冠病毒疫苗和肿瘤、免疫系统疾病、罕见病等领域的临床急需治疗药物,其中多个为我国自主研发并拥有自主知识产权产品。
图1. 2021年1-9月CDE承办的1类新药上市申请情况
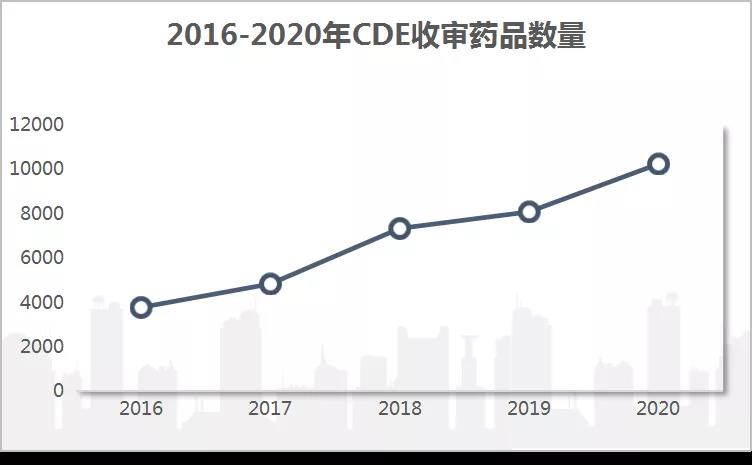
除此之外,自2016年以来药品受理数量呈现“直线式”上涨。其中2016年药品受理数量为3779件,2017年为4837件,2018年上涨到7336件,2019年收审8083件,2020年收审1,0241 件。
图2. 2016-2020年CDE收审药品数量
这种“直线式”的上涨与国家近些年鼓励药物创新的政策红利是分不开的。突破性治疗药物、附条件批准、优先审评审批及特别审批程序等多条药品加快上市通道的建立为处于激烈竞争中的研发企业节省了大量时间。对于药品来讲时间线就是生命线,上市前时间的缩短就意味着上市后药品销售时间的延长,企业在其中能获得的回报是相当可观的。尤其对于一些竞争激励的头部靶点药物而言,其上市时间的早晚直接决定了其上市后市场份额占比情况。
除了以上提到的药品加快上市通道,药审中心还新建了eCTD板块。所谓eCTD即电子通用技术文档,是对通用技术文档的电子化呈现和管理。采用eCTD可以使申报资料编制、申报、受理、审评、全生命周期管理和档案存储更加便捷经济,在保障质量的同时提高审评效率。更重要的是eCTD所使申报资料的格式、内容及标准要求保持全球通用性和一致性,有利于推动我国药品注册技术标准进一步与国际接轨。
药审中心专家也表示在之后的的工作中将进一步建立真实世界研究相关指导原则体系并更好地完成ICH指导原则在中国的转化应用。
2.儿童用药研发是趋势
在药审中心2021年8月27日发布的新闻动态中,国家药监局药审中心主任孔繁圃表示,下一步药审中心将针对全球尚未批准儿童应用,但境内外指南已明确推荐儿童应用的药品,进行回顾性研究或探索真实世界数据支持儿童用药研发的模式。通过遴选品种开展试点,提供儿童应用证据,支持说明书适应症扩展,解决临床经验性给药的问题,消除广大家庭的儿童用药安全隐患。
与成人不同,儿童的身体尚在发育中,肝肾对药物的代谢能力和药品不良反应的承受能力低。长期过度服用或不当服用成人药物会对儿童身体造成不可逆影响。而且成人用药对儿童来说也存在吞咽困难、气味难闻等一系列顺应性问题。目前儿童用药面临这品种少、规格少、专用剂型少以及供应量不足的问题。“吃药靠掰,用量靠猜。”是儿童药在临床应用的现状,很多家长对不能确定儿童用药的剂量,只能按照比例服用成人用药。
而儿童用药的研发之所以面临这样的问题,归根结底是因为企业研发投入与收益不匹配。儿童用药的特殊性直接导致了儿童药研发耗时长,临床研究风险高,处方工艺相对复杂,对原料辅料选择及质量控制要求高等研发特点。这些特点意味着如果按照药物活性成分定价,所获收益根本无法覆盖药企支出的成本。所以在推进儿童用药的研发方面,需要有关部门制定儿童用药准入及定价鼓励政策,让企业有利可图是关键。
有关部门现已将“支持儿童药研发”定为“我为群众办实事”实践活动的重要内容以及“药品监管惠企利民十大项目”之一。在新版药审中心网站中也开通了儿童用药专栏,将儿童用药相关政策法规、指导原则等文件集中公开,方便研究机构和企业提前准备申请材料。除此之外,药审中心还开通了儿童用药审评的绿色通道,设立了“儿童用药”特殊标识,由项目管理人专人对接,督导审评进度,确保按时限推进。
国家药监局所公布的数据显示,2020年国家药监局共批准儿童专用药和增加儿童应用的药品26个,同比增加36.8%。2021年截止9月已有14个儿童用药获批上市,另有数十个儿童专用药和增加儿童适应症或用法用量品种正在审评中,其中22个品种已经纳入优先审评审批序列。
目前共有8个儿童用药指导原则,其中有一半的公布日期在2020年1月1日以后。此外,药审中心已将《儿童用化学药品改良型新药临床试验技术指导原则》《化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则》《注意缺陷多动障碍药物临床试验技术指导原则》和《罕见病药物临床研究技术指导原则》共4项技术指导原则纳入年度计划。预计2021年底,儿童用药相关指导原则将累计发布13项。
图3. 部分国内儿童用药指导原则
那么儿童药物研发有哪些方面的考量呢?
对此,药审中心化药临床一部部长杨志敏建议,第一,儿童药研发需要依据临床急需情况而定,主要集中在常见病和多发病领域,要严格明确药物的给药计量标准;第二,儿童药研发可以结合临床的实际情况,很多药物在临床已经应用很多年,也被临床指南和专家共识收纳,这些药物可以通过探索真实世界研究数据增补儿童适应症;第三,最难当属罕见病药物研发,这部分药物的研发工作要多参与国际合作。
3.小结
想要做好药,跟着政策走。在之后的药物研发领域创新是重点,国内的创新药靶点赛道拥挤,想要从激烈的竞争中跳出来就要做好创新的差异化。
总得来说,
药物创新是大势,儿童用药需关注,政策来了别错过。
信息来源:










收藏
登录后参与评论