前言
随着人口老龄化,痴呆症的发病率在全球范围内持续上升,根据世界卫生组织(WHO)的最新数据[1],目前全世界有超过5500万人患有痴呆症,阿尔茨海默病(AD)是最常见的痴呆症形式,占60-70%的病例。
AD的病理特征是淀粉样蛋白-β(A-β)的积累导致老年斑的形成,以及细胞内基于tau蛋白的神经纤维缠结。故目前治疗AD的主要方向是A-β病理和tau病理,其中包括β-分泌酶抑制剂、增强A-β清除的药物、tau蛋白过度磷酸化抑制剂、tau蛋白聚集抑制剂、促进tau蛋白清除的药物等[2]。
自2001年Sakamoto等人首先提出[3]了PROTACs(蛋白水解靶向嵌合体)概念起,PROTACs被用于癌症、心血管疾病和神经退化性疾病方面,直到2022年底,有15个PROTACs进入了治疗肿瘤的不同阶段的临床试验。近些年,PROTACs用于治疗阿尔兹海默症受到了广泛的关注。
一、什么是PROTACs?它是如何起作用的?
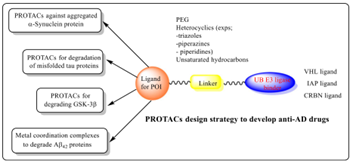
图1 PROTACs的结构[4]
PROTACs是一种异双功能分子,由两个活性结构域与一个连接子通过共价键构成,如图1所示,中间的部分是连接子,左结构域是靶蛋白配体,与要降解的靶蛋白结合,右结构域是E3连接酶配体,与E3泛素连接酶结合。
在介绍PROTACs的作用机制前,我需要引进一个概念:泛素-蛋白酶体系统(UPS)。神经元细胞的不可再生性使它们容易受到积聚的多余蛋白质的毒性作用,神经元依赖细胞蛋白酶体来维持细胞内稳态并清除这些多余的蛋白质,有两个主要的途径负责启动这一清除周期:UPS和自噬溶酶体途径。
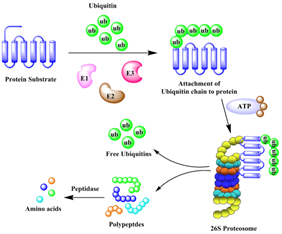
图2 泛素-蛋白酶体系统引起的蛋白降解作用[5]
UPS降解蛋白质的过程很简单,如图2所示,首先,E1连接酶激活泛素并将其与E2缀合酶结合,然后E2缀合酶与E3连接酶形成复合物,E3连接酶识别连接靶蛋白并将泛素共价连接到靶蛋白上,最终,泛素链形成后,蛋白质被26S蛋白酶体识别和降解[5]。
而今天的主角——PROTACs通过将靶蛋白和E3连接酶撮合在一起,“劫持”细胞的USP来实现降解。PROTACs与抗体药物偶联物(ADC)的结构设计原理极其相似,只不过前者的目的是定向爆破,而后者的目的是定向运输。
二、PROTACs治疗阿尔兹海默症的最新进展
1、针对tau蛋白的PROTACs
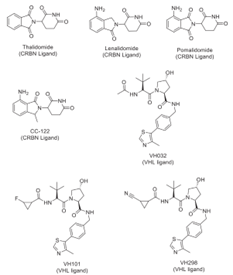
图3 常用的CRBN和VHL[4]
VonHippel-Lindau(VHL)和cereblon(CRBN)是两种非常流行和常用的E3连接酶配体,由于它们的特异性和对E3连接酶的亲和力,它们经常被用作E3连接酶配体,一些常用的VHL和CRBN如图3所示。
除此之外,其他小分子配体,如凋亡抑制剂(IAP)、DDB1和cul4相关因子(DCAF15,DCAF16
)、Keap1和环指蛋白(RNF4,RNF114)也被尝试用作设计PROTACs[4]。
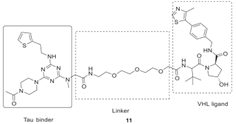
图4 Wang等人设计的新型PROTACs分子[6]
Wang等人[6]设计了新型PROTACs分子(化合物11,如图4所示)来连接E3连接酶(使用VHL配体)和tau蛋白,实验所用的HEK293和SHSY5Y细胞中通过USP实现高效率的tau蛋白清除。
并且随后小鼠实验表明,单次和多次皮下注射均可降低野生型、htau转基因和三次转基因小鼠的tau蛋白水平,且认知功能也有所改善。但是要想将这种药物应用到临床,还必须进行进一步的研究。
2、针对α-synuclein蛋白的PROTACs
α-synuclein蛋白(α-syn)的氨基酸序列由n端、c端和一个将α-synuclein整合成淀粉样纤维的核心疏水区组成。错误折叠和聚集的α-syn以类似朊病毒的方式从一个细胞扩散到另一个细胞,导致纤维扩增并向共核病发展。
注:目前将α-syn异常积聚所引起的神经系统变性病统称为共核病,包括AD,肌萎缩侧索硬化(ALS),帕金森病(PD),多系统萎缩(MSA)和路易体痴呆(DLB)等。
许多研究表明,α-syn在AD病变较多的脑区强烈表达,并且α-syn在皮质区富集与A-β的存在有关[7]。
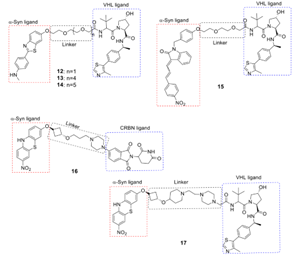
图5 6个通过α-syn治疗AD和PD的PROTACs[8]
Kargbo等人[8]设计了通过α-syn治疗AD和PD的PROTACs,共报道了6种PROTACs的设计方案,如图5所示,均具有E3连接酶配体中的VHL或CRBN。
与二甲基亚砜(DMSO)相比,化合物12-14和17可降解和清除超过65%的α-syn蛋白,而化合物15和16可降解和清除35%-70%的蛋白。根据生物学数据可以得出结论,VHL(化合物12-14和17)在蛋白质降解方面比CRBN(化合物15和16)更有前景。
3、针对糖原合成酶激酶-3β(GSK3β)的PROTACs
GSK3β是一种多功能的蛋白激酶,属于磷酸转移酶家族。该蛋白在大脑中的表达量最大,并且随着年龄的增长而增加。GSK3β的过表达诱导tau蛋白的过度磷酸化,从而导致神经营养因子(NFTs)的形成。少数研究表明,GSK3β也参与AD患者大脑中成对螺旋丝的形成。它的促炎作用也可能导致大脑神经元的丧失,因此,它是触发AD病理的重要因素之一[9]。
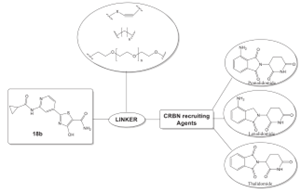
图6 用于降解GSK3β的PROTACs[10]
Jiang等人[10]设计了含有E3连接酶配体CRBN的PROTACs,能够在纳米级范围内抑制GSK3β。该PROTACs采用已知的GSK3β抑制剂(18b)作为靶蛋白配体设计PROTACs,所使用的E3连接酶配体为波马度胺、沙利度胺和来那度胺,如图6所示。
由于设计的PROTACs分子量较高,在大多数情况下降解GSK3β的效率不是很高。在随后设计合成的分子中,仅有39个分子对GSK3β蛋白有一定的抑制作用(抑制率为44.2%),针对GSK3β设计的PROTACs有潜力进一步开发成新的治疗方法。
4、辅助PROTACs治疗AD的方法
(1)利用铜配合物辅助降解Aβ42蛋白
细胞外的Aβ蛋白积累不能被PROTACs有效清除,因此研究人员使用了一些额外的蛋白降解方法,比如利用金属配位化合物的形成来切割蛋白。Junghun等人[11]在2007年研究了铜配位化合物在可溶性Aβ42蛋白降解中的作用,已知Aβ42蛋白可引起脑细胞的神经毒性,因此,Aβ42蛋白的降解可以阻止Aβ斑块的形成。
(2)利用天然化合物辅助降解tau蛋白
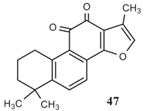
图7 丹参酮IIA[12]
丹参酮IIA是天然产生的菲醌衍生物,如图7所示,它是从丹参根中提取的。以往的研究已经证明了丹参酮IIA的作用:降低大鼠脑皮层神经元细胞内的活性氧(ROS),进而有助于降低Aβ毒性。此外,丹参酮IIA增强了tau蛋白的多聚泛素化,从而有助于降解tau蛋白[12],设计化合物47的衍生物有助于开发针对tau蛋白且更优的靶向降解药物。
三、优势与挑战
与传统的用于AD治疗的小抑制剂分子相比,PROTACs有很大的优势:
1. 利用UPS机制靶向破坏靶蛋白是PROTACs治疗AD最重要的优点之一,其他传统技术在不考虑其负反馈效应的情况下抑制靶蛋白。
2. 小分子通常占据靶部位才会起作用,需要更频繁和高剂量的药物在靶部位,这可能导致药物脱靶效应。PROTACs可以提高药物的特异性,减少设计药物的脱靶效应。
3. 由于与靶蛋白形成一个可逆的非共价键,PROTACs也能够在泛素化后从三元复合物中脱去自己,从而为下一个循环做好准备。因此,这些药物只需要在亚化学计量范围内提供,因此可以避免由于药物脱靶效应而产生的许多毒性[13]。
4. 此外,临床上已知的蛋白酶体中有75-80%明显不适用于小分子药物,这可能是由于小分子药物无法达到上述细胞内蛋白靶点所致。然而,细胞内蛋白聚集物很容易被PROTACs获得,这使其成为开发抗AD治疗的候选药物[14]。
目前,通过PROTACs治疗AD的研究还很少,在考虑将PROTACs用于抗AD药物开发之前,还必须克服包括理化特性评估和药代动力学在内的许多挑战:
1. 在设计PROTACs时首先要解决的是它们跨越血脑屏障的能力,少数研究已经提供了证据,证明了PROTACs穿透血脑屏障的能力。Chu等人[15]证明了他们设计的PROTACs可以穿过血脑屏障,并且脑不同部位E3连接酶的表达不同,因此,需要仔细确认其在大脑目标区域的表达。
2. 随着疾病的发展,tau蛋白的积累会扩散到大脑的不同区域。因此,设计的PROTACs应该能够靶向大脑不同区域积累的tau蛋白,已有研究表明,PROTACs在小剂量和间歇剂量下是有效的[16]。
3. 如果AD有遗传背景,PROTACs在治疗AD中并不重要,因为它们只清除积累的和错误折叠的蛋白质。有证据表明,蛋白酶体活性在大多数AD病例中受到抑制,PROTACs不能增强人体内蛋白酶体的活性,因此这种类型的治疗应该与一些基因编辑技术(如CRISPR-Cas-9技术)一起应用于患者,这些技术可以增强蛋白酶体的活性[17]。
总结
PROTACs是一种新的、有前途的治疗策略,通过降解累积的tau蛋白、α-syn蛋白和GSK3β蛋白来治疗AD,VHL和CRBN是AD中最常用的E3连接酶配体,最近发现了许多新的连接酶,可进一步改善PROTACs的治疗谱。
PROTACs有助于降低常规抑制剂的剂量、毒性和克服耐药性问题,在纳摩尔或皮摩尔浓度下,PROTACs能够直接降解靶蛋白,并且不抑制酶的活性。此外,由于PROTACs在本质上是选择性的,使用频率和剂量都较低,它们可以帮助将神经障碍患者长期使用药物的不良反应降至最低。
目前关于PROTACs在AD中的作用的研究还很少,大多数研究都采用了体外实验,数据有限,不足以得出关于AD大脑中PROTACs活性的准确结论,因此,需要进一步的体内研究来评估PROTACs治疗AD的可行性和疗效。
总的来说,PROTACs技术正在迅速发展,虽然还存在一些难题,但在科学家的共同努力下,这些难题将在不久的将来被攻克。
相关阅读:
参考文献:
[1]https://www.who.int/news-room/fact-sheets/detail/dementia.
[2]Pardo-Moreno T, González-Acedo A, Rivas-Domínguez A, et al. Therapeutic approach to Alzheimer’s disease: Current treatments and new perspectives[J]. Pharmaceutics, 2022, 14(6): 1117.
[3] Sakamoto K M, Kim K B, Kumagai A, et al. Protacs: Chimeric molecules that target proteins to the Skp1–Cullin–F box complex for ubiquitination and degradation[J]. Proceedings of the National Academy of Sciences, 2001, 98(15): 8554-8559.
[4] George N, Akhtar M J, Balushi K A, et al. The emerging role of proteolysis targeting chimeras (PROTACs) in the treatment of Alzheimer’s disease[J]. Medicinal Chemistry Research, 2023: 1-16.
[5] Bhatia S, Singh M, Singh T, et al. Scrutinizing the therapeutic potential of PROTACs in the management of Alzheimer’s disease[J]. Neurochemical Research, 2023, 48(1): 13-25.
[6] Wang W , Zhou Q , Jiang T , et al. A novel small-molecule PROTAC selectively promotes tau clearance to improve cognitive functions in Alzheimer-like models[J]. Theranostics, 2021, 11(11):5279-5295.
[7] J Burré, Sharma M , TC Südhof. Cell Biology and Pathophysiology of α-Synuclein[J]. Cold Spring Harbor Perspectives in Medicine, 2017:a024091.
[8] Kargbo R B. Treatment of Alzheimer’s by PROTAC-Tau protein degradation[J]. ACS Medicinal Chemistry Letters, 2019, 10(5): 699-700.
[9] Credle J J, George J L, Wills J, et al. GSK-3β dysregulation contributes to parkinson’s-like pathophysiology with associated region-specific phosphorylation and accumulation of tau and α-synuclein[J]. Cell Death & Differentiation, 2015, 22(5): 838-851.
[10] Jiang X, Zhou J, Wang Y, et al.
PROTACs suppression of GSK-3β, a crucial kinase in neurodegenerative diseases[J]. European Journal of Medicinal Chemistry, 2021, 210: 112949.
[11] Suh J, Yoo S H, Kim M G, et al. Cleavage agents for soluble oligomers of amyloid beta peptides[J]. Angewandte Chemie (International ed. in English), 2007, 46(37): 7064-7067.
[12] Cai N, Chen J, Bi D, et al. Specific degradation of endogenous tau protein and inhibition of tau fibrillation by tanshinone IIA through the ubiquitin–proteasome pathway[J]. Journal of agricultural and food chemistry, 2020, 68(7): 2054-2062.
[13] Moreau K, Coen M, Zhang A X, et al. Proteolysis‐targeting chimeras in drug development: a safety perspective[J]. British Journal of Pharmacology, 2020, 177(8): 1709-1718.
[14] Fisher S L, Phillips A J. Targeted protein degradation and the enzymology of degraders[J]. Current opinion in chemical biology, 2018, 44: 47-55.
[15] Higgins J J, Tal A L, Sun X, et al. Temporal and spatial mouse brain expression of cereblon, an ionic channel regulator involved in human intelligence[J]. Journal of neurogenetics, 2010, 24(1): 18-26.
[16] Mares A, Miah A H, Smith I E D, et al. Extended pharmacodynamic responses observed upon PROTAC-mediated degradation of RIPK2[J]. Communications biology, 2020, 3(1): 140.
[17] Devulapalli R, Jones N, Farrell K, et al. Males and females differ in the regulation and engagement of, but not requirement for, protein degradation in the amygdala during fear memory formation[J]. Neurobiology of learning and memory, 2021, 180: 107404.
<END>









收藏
登录后参与评论