
年销售额超过10亿美元的药物被称为“重磅炸弹”药物。泽布替尼自获批以来,销售额一路突飞猛进,其2020年至2022年销售业绩分别为4170万美元、2.18亿美元、5.647亿美元。2024年2月26日,百济神州公布2023年全年财报,报告显示,泽布替尼全年全球销售额达13亿美元,标志着我国第一款“重磅炸弹”药物的诞生。
百济神州于2012年立项研发布鲁顿酪氨酸激酶(BTK)抑制剂,当时国际还没有批准上市的药物,百济神州从设计合成的500多个化合物中优选出了候选物,于2014年开始了临床试验,到2019年底FDA批准泽布替尼上市,2020年6月,泽布替尼获NMPA批准在中国上市。
统计数据显示,每年出现的“重磅炸弹”药物距离其第一次上市的时间通常需要大约10年。而泽布替尼自2019年在美国取得首次批准以来,短短4年后成为“重磅炸弹”药物,速度可谓之快,同时也印证了这款药物的优异性。
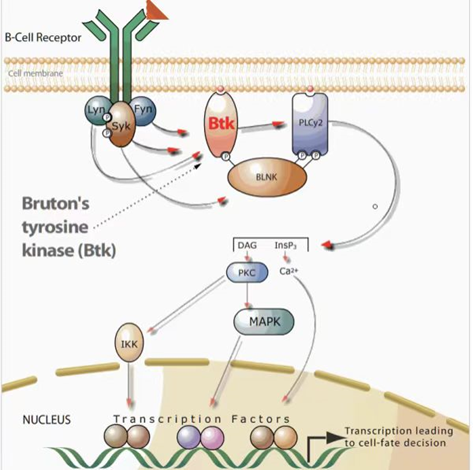
泽布替尼被用于复发难治性套细胞淋巴瘤的治疗,7年的时间创制了一个国际水平的新药,可谓高质量高效率的研发。目前该药物在全球超65个国家获批上市,成为适应证覆盖最广泛的BTK抑制剂。
在泽布替尼上市之前,国际范围内已有两款BTK抑制剂获得上市,分别是2013年Pharmacyclics和强生公司首创的伊鲁替尼和2017年阿斯利康公司的阿卡替尼。泽布替尼是继依鲁替尼和阿卡替尼之后FDA批准的第三个BTK抑制剂,是在我国本土研发成功的。泽布替尼的上市,成为历史上第一个完全由中国企业自主研发在FDA获批的创新药。
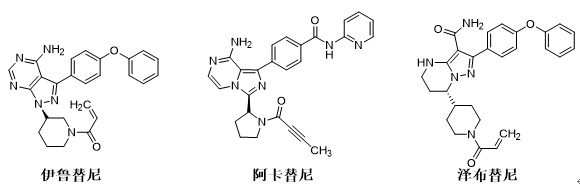
泽布替尼从研发开始即对标依鲁替尼,研发者发现伊鲁替尼口服生物利用度低,剂量偏大,治疗窗口窄,而且对野生型表皮生长因子受体(EGFR)呈现抑制,引起皮疹和腹泻等不良反应。所以提高口服吸收性和选择性,可降低用药剂量,扩大治疗窗口,减少不良反应就成为泽布替尼的研发目标。
研发之初,研发人员将先导化合物变换氨基咪唑母核,得到了吡唑并苯并咪唑的衍生物,随后引入丙烯酰胺”弹头”,显著提高了化合物活性。将三环稠合的母核改为单键连出,可显著降低化合物刚性,有效改善药物药代动力学性质。由于过程中变换母核合成的吡唑并吡啶的化合物活性很低,遂变换母核为吡唑并哌啶,部分饱和化降低了分子的平面性,有利于位点结合。随后经过末端苯氧基的变换和携带迈克尔加成片段的结构变换,提高了抑制BTK的选择性抑制和化合物的生物利用度,并且降低了对EGFR的作用。先导化合物经过以上一系列的骨架演化,最终确定了泽布替尼的最终结构,并最终成功上市。

临床上,泽布替尼的表现也十分亮眼。据百济神州2022年公布的临床数据显示,在针对难治或复发性慢性淋巴细胞白血病以及小淋巴细胞淋巴瘤的治疗效果方面,泽布替尼的无进展生存率为79.5%,而伊布替尼为67.3%。安全性方面,使用泽布替尼的患者无心源性死亡事件,而使用伊布替尼的患者心源性死亡事件发生率为1.9%。综合有效性以及安全性,泽布替尼显示出优效性,正式坐实同类最佳。
此次泽布替尼突破十亿美元大关不仅印证了百济神州全球化路径的成功,更重要的是它打破了国内创新药没有“重磅炸弹”药物的纪录,具有重要意义。目前,百济神州围绕泽布替尼在全球范围内进行了广泛的临床试验项目,研究泽布替尼单药和与其他疗法进行联合用药治疗多种B细胞恶性肿瘤,期待未来有更多关于泽布替尼的好消息,也希望未来有更多国产创新药走出中国,走向国际。
参考资料:
[1]百济神州官网:https://www.beigene.com.cn/
[2]郭宗儒.我国创制的抗肿瘤药物泽布替尼[J].药学学报,2020,55(08):1978-1982.
[3]Guo Y, Liu Y, Hu N, et al. Discovery of Zanubrutinib (BGB-3111), a Novel, Potent, and Selective Covalent Inhibitor of Bruton's Tyrosine Kinase. J Med Chem. 2019;62(17):7923-7940.
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!













收藏
登录后参与评论