2023年10月30日,Galapagos宣布已和Alfasigma签署意向书,将Jyseleca业务转让给Alfasigma,包括欧洲和英国的营销授权、Jyseleca的商业、医疗和开发活动以及在14个欧洲国家的约400个职位。在拟议的交易中,Galapagos将获得5000万欧元的首付款、潜在的里程碑付款总额为1.2亿欧元以及欧洲销售额的中个位数至中两位数的特许权使用费。到2025年6月之前,Galapagos将向Alfasigma支付高达4000万欧元,用于Jyseleca的相关开发活动。此外,Galapagos还计划精简剩余业务,进一步提高效率,公司预计每年可节省1.5~2亿欧元。
Jyseleca(filgotinib)是Galapagos和吉利德共同推出的JAK产品,2020年在欧洲和日本获批用于类风湿性关节炎,2021年在欧洲获批用于治疗溃疡性结肠炎,目前已在十多个国家/地区获批用于治疗类风湿性关节炎(RA)和溃疡性结肠炎(UC)。
2012年,Galapagos曾与艾伯维合作开发filgotinib,但艾伯维在2015年退出后专注于内部药物Rinvoq(乌帕替尼)的研究。随后几个月,Galapagos就与吉利德签署协议进行该药物的进一步商业化,2020年底,filgotinib遭遇FDA批准的重重障碍,Galapagos和吉利德的股价分别下跌了29%和7%,Galapagos不得不出售了旗下的CRO公司Fidelta,而吉利德也调整了与其大部分合作。2023年2月,Galapagos公布了DIVERSITY试验的顶线结果,这是一项临床试验3期研究,旨在评估filgotinib(100mg或200mg,每日一次)在中度至重度克罗恩病(CD)患者的诱导和维持治疗中的安全性和有效性。该研究中的两个诱导队列均未达到filgotinib 100mg和200mg每日一次的临床缓解和内窥镜反应的共同主要终点。根据这些顶线数据,Galapagos决定不在欧洲提交上市许可申请。此次研究的失败,无疑是对陷入困境的JAK抑制剂造成了又一次打击。随后几个月,Galapagos只能将公司的唯一商业产品转让出去,进一步减少财政支出,以维系其他研究。
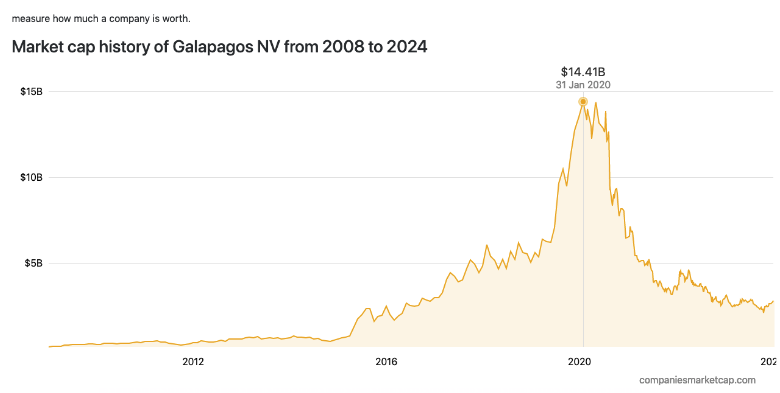
Galapagos首席执行官兼董事长Paul Stoffels博士表示,转让Jyseleca的交易预计将释放公司的大量资源,公司能够在研发增长领域、业务发展和并购方面进行更多投资,这将支持并加速其转型为一家全球创新型生物技术公司,拥有一系列一流的药物,以满足大量未满足的需求。截止2024年1月8日收盘公司市值约28亿美元。
https://companiesmarketcap.com/galapagos-nv/marketcap/
01公司介绍
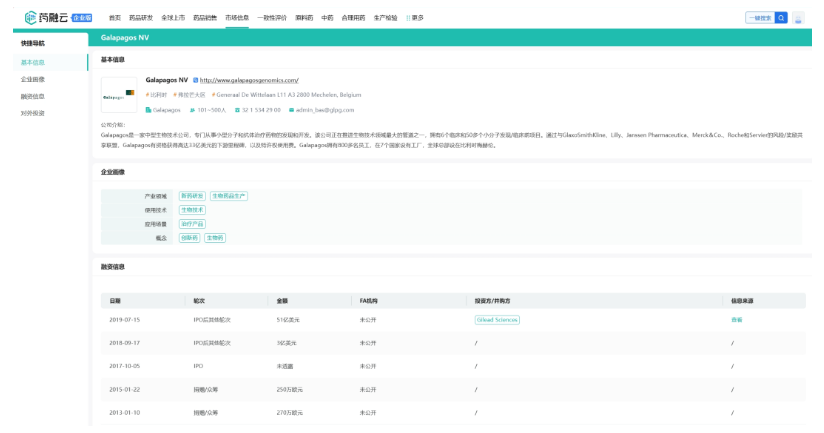
药融云数据库监测显示:总部位于比利时的Galapagos创立于1999年,最初是Crucell和Tibotec的合资企业,2005年在纳斯达克上市。公司一直专注于小分子创新药物,疾病领域也聚焦在炎症、纤维化和肾脏疾病,2022年通过收购CellPoint和AboundBio,公司进军肿瘤学、CAR-T和生物制剂领域,作为公司战略转型的第一步,此次收购无疑加速了公司的管线多样化步伐。
(注:CAR-T(Chimeric antigen receptor T cell,嵌合抗原受体T细胞)疗法,是指通过基因修饰技术,将带有特异性抗原识别结构域及T细胞激活信号的遗传物质转入T细胞,使T细胞直接与肿瘤细胞表面的特异性抗原相结合而被激活,通过释放穿孔素、颗粒酶素B等直接杀伤肿瘤细胞,同时还通过释放细胞因子募集人体内源性免疫细胞杀伤肿瘤细胞,从而达到治疗肿瘤的目的,而且还可形成免疫记忆T细胞,从而获得特异性的抗肿瘤长效机制。)
自成立以来,公司总融资五轮,最近的一次是2019年7月,与吉利德科学达成了10年的全球研发合作协议,潜在金额高达50.5亿美元。根据协议,Galapagos获得39.5亿美元的预付款和11亿美元的股权投资。吉利德获得一系列创新的化合物组合,以及在欧洲以外所有国家开发和商业化当前和未来项目的独家权益。此次合作最成功的结果就是Galapagos前不久决定转让的旗下唯一商业化的产品——JAK抑制剂Filgotinib。
药融云数据库:融资情况
02 战略评估重新定位
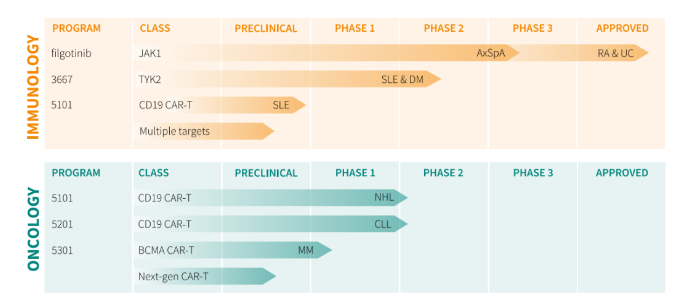
曾经公司市值高达120亿欧元(约140亿美元),在经历重大研发失利之后。公司进行重大战略调整,现在的Galapagos主要专注于免疫学、肿瘤学和其他治疗领域的研究创新。在免疫学中的管线主要涉及类风湿性关节炎(RA)、溃疡性结肠炎(UC)、轴向脊椎关节炎(AxSpA)、皮肌炎(DM)和系统性红斑狼疮(SLE)。肿瘤学管线主要涉及非霍奇金淋巴瘤(NHL)、慢性淋巴细胞白血病(NHL)和多发性骨髓瘤(MM)。
根据Galapagos之前的报道,Filgotinib针对中轴型脊柱关节炎的研究进行到临床试验3期,该OLINGUITO试验包括两项平行研究,主要评估Filgotinib在活动性影像学中轴型脊柱关节炎(r-AxSpA)和非影像学中轴型脊柱关节炎(nr-AxSpA) 患者中的疗效和安全性。2023年4月,OLINGUITO试验的第一批患者已经进行给药,预计2025年下半年将取得顶线结果。在临床试验2期研究中,filgotinib 200mg在第12周(主要终点)的强直性脊柱炎疾病活动评分(ASDAS)显著改善,并且在对常规治疗无反应的活动性r-AxSpA患者中具有令人鼓舞的安全性。(注:中轴型脊柱关节炎(AxSpA)也称为强直性脊柱炎,是一种慢性炎症性疾病,主要累及骶髂关节和脊柱,其特征是疼痛、僵硬和疲劳,通常导致功能障碍)Alfasigma将继续该药物后续的研发。
GLPG3667是一种研究性、新型、口服、可逆和选择性酪氨酸激酶2(TYK2)抑制剂,目前正在开发用于皮肌炎(DM)和系统性红斑狼疮(SLE),均进行到临床试验2期。2023年5月23日,Galapagos宣布针对皮肌炎的GALARISSO试验的首位患者已接受给药,这是一项随机、双盲、安慰剂对照、多中心研究,旨在评估GLPG3667的有效性和安全性。将在24周内对大约62名成年DM患者进行每日口服GLPG3667 150毫克或安慰剂的研究。如果获得批准,该药物有可能成为皮肌炎的第一个选择性口服TYK2抑制剂。2023年8月28日,针对系统性红斑狼疮的GALACELA试验的首例患者已随机分配,该试验是一项随机、双盲、安慰剂对照、多中心研究,旨在评估GLPG3667治疗成人活动性SLE的疗效、安全性、耐受性、药代动力学和药效学。
药融云数据库:基本信息
注:特发性炎症性肌病(IIM)是一组罕见的、以肌肉炎症和多种肌外表现为特征的异质性自身免疫性疾病,通常为慢性或亚急性发作,主要包含多发性肌炎(PM)、皮肌炎(DM)、包涵体肌炎(IBM)等亚型。系统性红斑狼疮是一种慢性、炎症性、自身免疫性疾病,发病机制特征是自身反应性T细胞和B细胞激活时全身性丧失,这导致主要针对多种核抗原的致病性自身抗体的产生,沉积在组织中并激活补体,导致器官损伤。
GLPG5101是第二代CD19/4-1BB CAR-T候选产品,以单次固定剂量静脉输注给药。目前正在开发用于系统性红斑狼疮(SLE)和非霍奇金淋巴瘤(NHL),针对系统性红斑狼疮的研究处于临床前阶段,针对非霍奇金淋巴瘤的研究进入到临床试验2期。2023年12月初,Galapagos宣布剂量扩展队列中的首批惰性淋巴瘤和套细胞淋巴瘤患者已经给药。(注:非霍奇金淋巴瘤是一种起源于淋巴细胞的癌症,最初的症状通常是淋巴结肿大、发热和体重减轻。)
GLPG5201正在开发用于慢性淋巴细胞白血病(CLL),目前进行到临床试验1/2期,这是一项开放标签、多中心研究,旨在评估GLPG5201在复发/难治性淋巴细胞白血病(rrCLL)和小细胞淋巴细胞淋巴瘤(rrSLL)患者中的可行性、安全性和有效性。
GLPG5301是一种自体第二代/4-1BB B细胞成熟抗原(BCMA)导向的CAR-T候选产品,在床旁以单次固定剂量静脉输注新鲜产品的形式给药。进行到名为PAPILIO-1的临床试验1期,这是一项开放标签、多中心研究,旨在评估GLPG5301在既往一线治疗后的复发/难治性多发性骨髓瘤(rrMM)患者中的可行性、安全性和有效性。PAPILIO-1研究主要评估安全性并确定临床试验2期的推荐剂量。临床试验2期主要目的是评估GLPG5301的疗效,以客观缓解率(ORR)衡量。2023年12月19日,Galapagos宣布PAPILIO-1研究的首位患者已经给药。(关联阅读:
是中国创新药不行吗?)
注:多发性骨髓瘤(MM)的典型特征是浆细胞肿瘤增殖,产生单克隆免疫球蛋白,浆细胞在骨髓中增殖,可能导致广泛的骨骼破坏伴骨质减少,以及溶骨性病变伴或不伴病理性骨折。
03 财务状况
从药融云数据库获悉,虽然Galapagos在2020年之后推出了商业产品,但是相关的支出也在增多。目前整体的营收并没有那么乐观,2022年集团净收入为5.053亿欧元,运营亏损为2.675亿欧元,净亏损2.18亿欧元。
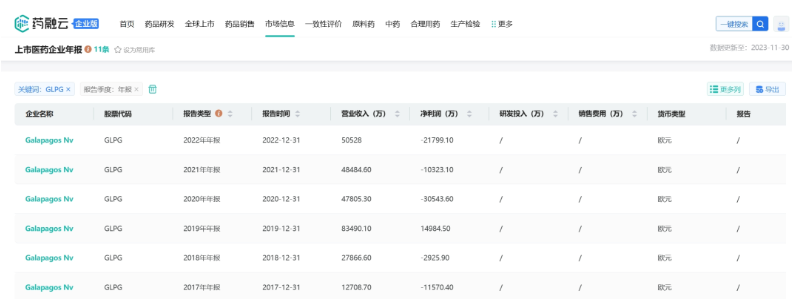
药融云数据库:公司年报
截止2023年9月30日的前三个季度Galapagos的总收入为4.489亿欧元,与上年同期相比增加了9%,包括Jyseleca在欧洲的净销售额8210万欧元,合作伙伴关系收入为3.668亿欧元。与Jyseleca净销售额相关的产品销售成本为1360万欧元;研发费用为3.122亿欧元,上年同期为3.641亿欧元,减少了14%;一般、销售和管理费用为1.822亿欧元;营业亏损总额为1900万欧元;截至2023年9月30日,当期金融投资以及现金及现金等价物为38.117亿欧元,而截至2022年12月31日为40.941亿欧元(不包括990万欧元的应收利息净收入),2023年前9个月现金和现金等价物以及流动金融投资共净减少2.824亿欧元。重申了Jyseleca 2023年全年净销售额指引为1.00~1.2亿欧元,2023年全年现金消耗指引为3.80~4.2亿欧元。
参考:
NMPA/CDE;
药融云数据库;
FDA/EMA/PMDA;
相关公司公开披露(除标注外,正文图片均来自企业官网)
https://www.glpg.com/;等等
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



 药融云数据库:公司年报
药融云数据库:公司年报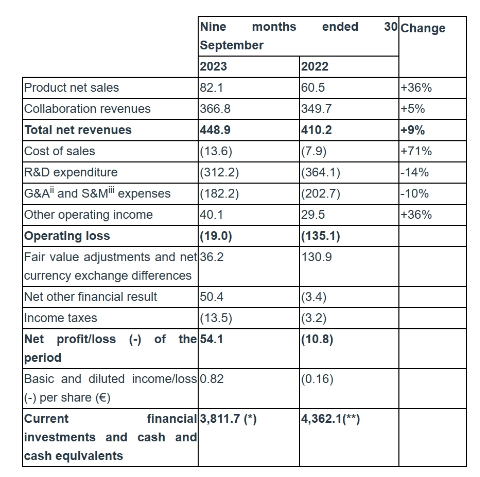













收藏
登录后参与评论