据
药融云数据库,近日,有
2款国产EGFR抑制剂新药启动临床试验。分别为来自海南越康生物的第3代EGFR-TKI药物、百利药业的国内首款EGFR/HER3双抗ADC药物。
一、海南越康生物:第3代EGFR-TKI药物
YK-029A是苏州浦合医药控股的子公司海南越康生物医药有限公司开发的第3代EGFR-TKI药,最早于 2017年8月17日在国内首次递交临床申请,次年1月获批临床,2022年9月,拟纳入突破性治疗药物,用于未经系统治疗的 EGFR 20外显子插入突变(EGFR ex20ins)晚期非小细胞肺癌 (NSCLC) 患者。
目前,该EGFR抑制剂新药共公示了2项临床试验。其中,I期临床于2018年5月首次启动。本次启动的随机、开放、多中心的III期临床试验,旨在评估YK-029A片对比含铂双药化疗一线治疗EGFR 20号外显子插入突变的局部晚期或 转移性非小细胞肺癌患者的有效性和安全性。
截图来源:药融云中国临床试验数据库
2022年CSCO年会上,公司公布了YK-029A项目一线治疗EGFR Exon20ins肺癌患者的临床1期研究(CTR20180350),入组队列1共15例(经治,150mg,QD)、队列2共10例(经治,200mg,QD)和队列3共28例(初治,200mg,QD),主要研究终点为ORR,次要研究终点包括PFS、DOR、DCR和安全性。结果显示ORR为68.4%,6个月DOR为65.3%,DCR为94.7%,中位PFS未达到,6个月的PFS率为68.4%,同时安全性良好,常见不良反应类型与传统的EGFR抑制剂类似。
肺癌是发病率及死亡率常年位居TOP3的大癌种。有资料显示,非小细胞肺癌占肺癌患者的90%,而对于亚洲患者而言,肺癌EGFR突变占到了40%以上。因此,各大药企前赴后继地开发EGFR抑制剂新药。
其中,针对EGFR 20外显子插入突变的NSCLC,NMPA于今年1月,首款获批了
武田制药的口服小分子新药
琥珀酸莫博赛替尼胶囊(Mobocertinib)。
迪哲医药/合全医药的
舒沃替尼片于今年1月递交的两项上市申请,均陆续纳入优先审评程序,有望成为国产首款获批用于EGFR 20号外显子插入突变的口服EGFR抑制剂新药(《
5款重磅新药获批上市,罗氏、诺华、百克为国内患者带来福音!》)。
除此之外,上海艾力斯医药旗下伏美替尼、必贝特医药旗下BEBT-109胶囊等品种对EGFR 20外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)的研究已至II期临床阶段(登记号分别为:CTR20221165、CTR20213409),进展在国内靠前。
二、百利药业:EGFR/HER3双抗ADC药物
BL-B01D1是由百利药业自主研发的靶向EGFR/HER3的双抗ADC药物,为国内首个申报临床的双抗ADC新药,可同时靶向EGFR/HER3,于去年11月首次启动临床。该药可实现针对EGFR依赖肿瘤的靶向杀伤并防止HER3引起的耐药。此外,它还能实现对肿瘤细胞的精准杀伤,减少小分子毒素对体内正常细胞的破坏。
2022年10月19日,百利药业双抗ADC药物BL-B01D1的临床试验申请获得NMPA的默示许可,用于治疗晚期或转移性上皮肿瘤。据药融云数据库,目前,该
EGFR抑制剂新药共有4项I期临床试验和2项II期临床试验正在进行中,癌种主要涉及妇科、泌尿系统和消化系统。
最新公示的为评价注射用BL-B01D1在复发或转移性妇科恶性肿瘤等多种实体瘤患者中的安全性、耐受性、药代动力学及有效性的Ib/II期临床研究。
截图来源:药融云中国临床试验数据库
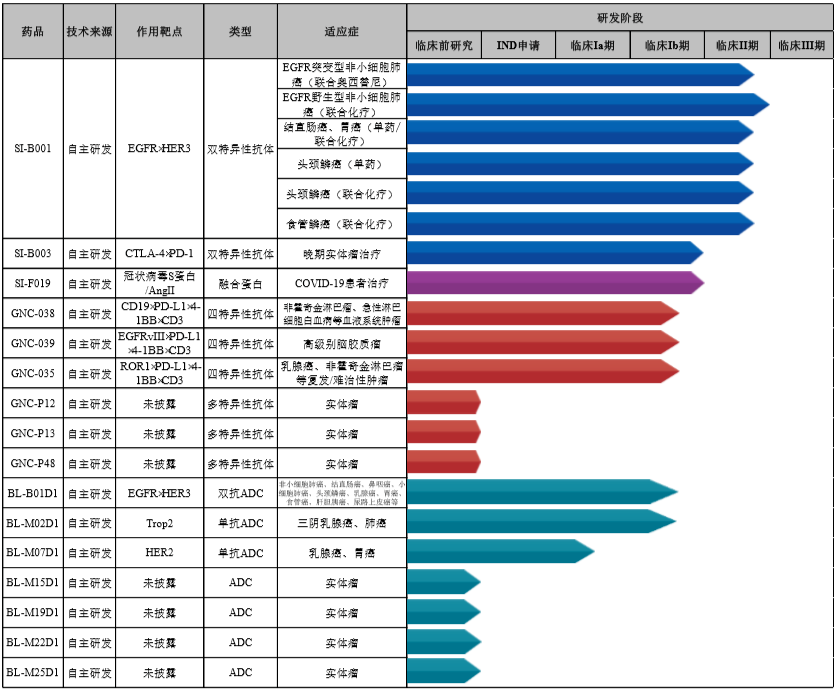
今年1月6日,百利天恒在上海证券交易所科创板正式上市。据其招股书,双特异性抗体、四特异性抗体、抗体偶联药物(ADC)等新型抗体领域为百利天恒发展方向和研发重点,拥有核心创新生物药在研品种16个,其中双特异性抗体候选药物SI-B001已陆续开展六个2期临床试验,另有8个候选药物处于1期临床研究阶段。
来源:百利药业企业招股书
参考来源:
[1] 药融云数据库
[2] 相关公司官方披露
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用! <END>









收藏
登录后参与评论